|
ВАНАДИЙ (от имени др.-сканд. богини красоты Ванадис, Vanadis;
лат. Vanadium) V, хим. элемент V гр. периодич. системы, ат. н. 23, ат.
м. 50,9415. Прир. В. состоит из стабильного изотопа 51V (99,76%)
и слабо радиоактивного 50V (T1/2 1014
лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов
4,98*10-28 м2. Конфигурация внеш. электронной оболочки
3d34s2; степень окисления от + 2 до +5; энергия (эВ)
ионизации при последоват. переходе от Vo к V5+ соотв.
6,74, 14,65, 29,31, 48,4, 65,2; электроотрицательность по Полингу 1,6;
атомный радиус 0,134 нм, ионные радиусы (в скобках - координац. числа В.):
V2+ 0,093 нм (6), V3+ 0,078 нм (6), V4+
0,067 (5), 0,072 (6) и 0,086 нм (8), V5+ 0,050 (4), 0,060 (5)
и 0,068 нм (6). Содержание В. в земной коре 1,9*10-2 % по массе
(в почве -1,0*10-2 %), в воде океанов -3*10-7 %,
золе растений - 6,1*10-3 %. Относится к рассеянным элементам.
В своб. виде в природе не встречается. Важнейшие минералы: патронит V(S2)2,
ванадинит Pb5(VO4)3Cl, деклуазит Pb(Zn,
Cu)(VO4)(OH), моттрамит 5(Cu, Pb)O*V2O5*2H2O,
тюямунит Ca(UO2)2(VO4)2*8H,O,
карнотит K2(UO2)2(VO4)2*3H2O,
роскоэлит KV2 [AlSi3O10](OH)2.
В нек-рых магнетитовых, титаномагнетитовых и осадочных железных рудах и
ванадийсодержащих фосфоритах содержится до 2,5-3,0% V2O5.
В. также присутствует в окисленных медно-свинцово-цинковых рудах (в виде
минералов), высокосернистых нефтях (до 300 г в 1т), битуминозных сланцах,
асфальтитах. Мировые запасы В. (без СССР) - 42 млн. т.
Свойства. В. - серебристо-серый металл; кристаллич. решетка кубич. объемноцентрированная,
а = 0,3024 нм, z = 2, пространств. группа Im3m. Т. пл. 1920°С, т.
кип. 3400°С; плотн. 6,11 г/см3; Сp° 24,95 Дж/(моль*К);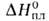 23,05 кДж/моль,
23,05 кДж/моль,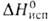 474 кДж/моль (1900°С); So298 28,9 Дж/(моль*К);
ур-ние температурной зависимости давления пара 1gр(мм рт. ст.) = - 26650/Т
- 0,112*10-3Т + 10,815 (293 - 2173 К); температурный
коэф. линейного расширения 8,98*10-6 К-1; теплопроводность
1,0 Вт/(м*К) (293 К);
474 кДж/моль (1900°С); So298 28,9 Дж/(моль*К);
ур-ние температурной зависимости давления пара 1gр(мм рт. ст.) = - 26650/Т
- 0,112*10-3Т + 10,815 (293 - 2173 К); температурный
коэф. линейного расширения 8,98*10-6 К-1; теплопроводность
1,0 Вт/(м*К) (293 К);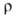 образца после холодной деформации 24,8*10-8 Ом*м, температурный
коэф.
образца после холодной деформации 24,8*10-8 Ом*м, температурный
коэф.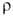 3,4*10-3 К-1 (273-373 К). В. парамагнитен, магн.
восприимчивость массивного образца 5,48*10-9. Стандартный электродный
потенциал V2+/V° - 1,50 В. Т-ра перехода в сверхпроводящее состояние
ниже 5,4 К. Для металла (очищенного иодидным методом) после отжига модуль
упругости 141000 МПа; пределы пропорциональности, текучести и прочности
при растяжении соотв. 85, 118 и 220 МПа; твердость по Бринеллю 600 МПа;
коэф. Пуассона 0,36; относит. удлинение 17-45%. В. пластичен, при нагр.
на воздухе выше 300°С становится хрупким. Примеси кислорода, водорода и
азота резко снижают пластич. св-ва В. и повышают его твердость и хрупкость.
3,4*10-3 К-1 (273-373 К). В. парамагнитен, магн.
восприимчивость массивного образца 5,48*10-9. Стандартный электродный
потенциал V2+/V° - 1,50 В. Т-ра перехода в сверхпроводящее состояние
ниже 5,4 К. Для металла (очищенного иодидным методом) после отжига модуль
упругости 141000 МПа; пределы пропорциональности, текучести и прочности
при растяжении соотв. 85, 118 и 220 МПа; твердость по Бринеллю 600 МПа;
коэф. Пуассона 0,36; относит. удлинение 17-45%. В. пластичен, при нагр.
на воздухе выше 300°С становится хрупким. Примеси кислорода, водорода и
азота резко снижают пластич. св-ва В. и повышают его твердость и хрупкость.
В. отличается высокой хим. стойкостью в морской воде, водных р-рах минер.
солей, довольно стоек к действию разб. соляной к-ты, не взаимод. на холоду
с разб. HNO3 и H2SO4. Реагирует с фтористоводородной
к-той, концентрированными HNO3 и H2SO4,
с царской водкой. Не взаимод. с р-рами щелочей, но в расплавах щелочей
в присут. воздуха окисляется с образованием ванадатов. Кислород раств.
в В., причем р-римость увеличивается с повышением т-ры. При содержании
кислорода до ~ 1% кристаллич. решетка В. остается кубической (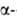 фаза),
при больших содержаниях она перестраивается в тетрагональную ( фаза),
при больших содержаниях она перестраивается в тетрагональную (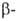 фаза),
что, по-видимому, является осн. причиной сильного влияния кислорода на
твердость В. При комнатной т-ре фаза),
что, по-видимому, является осн. причиной сильного влияния кислорода на
твердость В. При комнатной т-ре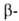 фаза
сохраняет гомогенность при содержании кислорода от 2,0 до 10,3%. При 600-700°С
происходит интенсивное окисление компактного металла до V2O5
(см. также Ванадия оксиды). фаза
сохраняет гомогенность при содержании кислорода от 2,0 до 10,3%. При 600-700°С
происходит интенсивное окисление компактного металла до V2O5
(см. также Ванадия оксиды).
Выше 700°С с N2 В. образует нитрид VN (желтые кристаллы,
т. пл. 2360 °С), с углеродом и углеродсодержащими газами выше 800°С - карбид
VC (черные кристаллы, т. пл. ок. 2830 °С, микротвердость 20900 МПа), с
С12 - хлориды и оксохлориды, с F2 - фториды и оксофториды
(см. Ванадия галогениды), с Н2 - твердые р-ры (р-римость
Н2 в 100 г В. 122,6 см3). С металлами В. дает сплавы
и интерметаллич. соединения. Ниже приводятся сведения о других соед. этого
элемента.
Галлид (галлид триванадия) V3Ga - светло-серые кристаллы;
не раств. в воде и орг. р-рителях. Получают его взаимод. V с Ga или галлиевой
бронзой при 1300°С, хим. осаждением из газовой фазы с использованием VC14
и GaCl3 в присут. Н2. Сверхпроводник с критич. т-рой
16,8 К; обладает высокой плотностью тока в сильных магн. полях (до 1*105
А/см2 при 18 Тл). Применяют V3Ga при изготовлении
обмоток соленоидов, кабелей для линий электропередачи, магнитов для магн.
подвесок.
Диборид VB2 - серые кристаллы; т. пл. ок. 2400°С; не раств.
в воде и орг. р-рителях. Получают восстановлением оксидов V бором или В4С
в вакууме при 1500-1600 °С, спеканием V и В. Компонент жаропрочных сплавов,
огнеупорный материал.
Силицид (силицид триванадия) V3Si - светло-серые кристаллы;
т. пл. 1910°С (с разл.); не раств. в воде и орг. р-рителях. Получают его
из V и Si конденсацией паров в вакууме или взаимод. в твердой фазе. Сверхпроводник
с критич. т-рой 17,2 К. Перспективен для использования в магн. системах
электротехн. устройств.
Сульфид (пентасульфид диванадия) V2S5 - черные
кристаллы; раств. в р-рах сульфидов щелочных металлов с образованием красно-бурых
р-ров тиованадатов - М3VS4, MVS3, M4V2S7;
получают взаимод. V2S3 с избытком S при 400°С. Сесквисульфид
V2S3 - черные кристаллы; при 1000°С диссоциирует
с образованием VS; получают при действии CS2 на V2O5,
нагретый до 700°С. Моносульфид VS - темно-коричневые кристаллы; получают
нагреванием V2S3 в среде Н2 при 850-1100
°С или сплавлением S с V2O5 при 400 °С в среде СО2.
О ванадиевых бронзах см. Бронзы оксидные. Получение. Осн. источник
В. - ванадийсодержащие железные руды. При их обогащении получают концентраты,
содержащие 60-67% Fe. Богатые В. концентраты (8-16%) в смеси с Na2CO3
или Na2SO4 окомковывают, а окатыши обжигают в окислит,
среде при 800-1300 °С. При этом низшие оксиды Fe и V окисляются и образуются
легкорастворимые ванадаты Na (V2O5 + Na2CO3
-> 2NaVO3 + CO2), к-рые при водной обработке переходят
в р-р. К последнему добавляют минер, к-ты (до рН 1,6-1,9) и нагревают до
90-95°С. При этом в результате гидролиза ванадатов образуется осадок (хим.
концентрат), к-рый после удаления влаги содержит 92-95% V2O5,
4,5-7,5% Na2O и примеси др. оксидов. При осаждении в присут.
солей аммония содержание Na2O в осадке значительно меньше.
Концентраты с содержанием В. ок. 1% подвергают окомкованию и термич.
упрочению (агломерации), а затем плавят в доменной печи. В. переходит в
чугун, а при продувке последнего в конвертере воздухом или кислородом -
в ванадиевый шлак (10-15% В.). Последний смешивают с Na2CO3,
NaCl или СаСО3 и обжигают в окислит. среде при 750-900°С. Обожженную
шихту выщелачивают водой или разб. H2SO4. Из р-ра,
как и в предыдущем случае, выделяют хим. концентрат, содержащий после сушки
до 92% V2O5.
Полученный по обоим способам хим. концентрат используют для выплавки
феррованадия и др. сплавов. Феррованадий (35-80% В.) получают путем восстановления
V2O5 ферросилицием или А1.
Значит. часть В. (в виде V2O5) получают в кач-ве
побочного продукта при переработке фосфоритов, апатитов, патронитовых,
карнотитовых, роскоэлитовых руд, бокситов, алунитов, медно-свинцово-цинковых
и др. полиметаллич. руд, золы высокосернистых нефтей и нефтепродуктов,
битуминозных сланцев. Патронитовые руды из-за большого содержания В. подвергают
сначала окислит. обжигу, а затем восстановит. плавке в электропечах с получением
феррованадия.
Металлич. В. высокой чистоты получают: восстановлением хлоридов В. (образуются
при хлорировании феррованадия) водородом; кальциетермич. восстановлением
V2O3 (образуется при восстановлении V2O5
водородом); магниетермич. восстановлением VC13; термич. диссоциацией
VI2 (при этом получают металл наиб. высокой чистоты); электролизом
расплавов галогенидов В. Чистота В. повышается (до 99,8-99,9%) после плавки
в вакуумных электронно-лучевых печах или электрорафинирования.
Определение. Для обнаружения V(V) в р-ре используют: р-цию с Н2О2
в 20%-ной H2SO4 (красное окрашивание) или в щелочной
среде (желтое окрашивание); восстановление в кислом р-ре действием SO2,
H2S, Fe2 + , спирта и др. (синее окрашивание);
осаждение из слабокислого р-ра сине-черного комплекса с таннином; образование
вишнево-красного соед. Fe(II) при добавлении в солянокислый р-р FeCl3,
диметилглиоксима и NH3; окрашивание р-ра в красно-бурый цвет
при добавлении (NH4)2S; осаждение белого осадка NH4VO3
при насыщении р-ра NH4C1 или др. При совместном растирании образца,
содержащего В., с 8-гидроксихинолином смесь окрашивается в желто-оранжевый
цвет, к-рый при нагр. переходит в густо-синий.
При количеств. определении В. образцы сплавляют с К2СО3
и Na2O2, а затем выщелачивают плав водой или разлагают
к-тами. Для отделения В. от сопутствующих элементов его осаждают в виде
ванадатов Са, Ва, Hg, Pb, Ag, малые кол-ва м. б. выделены аммиаком совместно
с А1(ОН)3 и Fe(OH)3. Используют также осаждение с
(NH4)3H4[P(Mo2O7)6],
8-гидроксихинолином, бензоатом аммония и др. орг. реагентами, электролиз
с ртутным катодом, экстракцию эфиром и отгонку В. в струе сухого НС1, ионный
обмен. Гравиметрически В. определяют в виде V2O5.
наиб. достоверные результаты получают с помощью титриметрич. методов, заключающихся
в предварит. восстановлении V(V) до V(IV) при действии SO2,
FeSO4 и нек-рых металлов и послед, титровании КМпО4.
Распространен способ окисления В. КМпО4 с послед, титрованием
р-ром соли Fe(II). Используют также потенциометрич., фотометрич. (с Н2О2)
и др. методы. Получили применение физ. методы определения В.: эмиссионный
спектральный, атомно-абсорбционный, нейтронно-активационный (с использованием
короткоживущего изотопа 52V) и др.
Применение. В. в осн. (на 85%) используют как легирующую добавку
для сталей, резко повышающую их прочность, сопротивление усталости и износоустойчивость.
В. в сталях быстрее, чем др. элементы, взаимод. с растворенным С, образуя
твердые и жаростойкие карбиды, к-рые, равномерно распределяясь в железе,
способствуют образованию мелкокристаллич. структуры.
В. используют также для легирования чугуна, как компонент сплавов для
постоянных магнитов, жаропрочных, твердых и коррозионностойких сплавов,
а также в кач-ве конструкционного материала для ядерных реакторов. Добавки
В. в золото повышают твердость последнего.
Мировое производство В. составляет ок. 25 тыс. т/год (1981). Важнейшие
страны-производители: ЮАР (~ 45%), США (~19%), Чили (-3%), Финляндия, Норвегия.
Соединения В. токсичны. Они могут поражать органы дыхания, пищеварения,
систему кровообращения и нервную систему, а также вызывать воспалит. и
аллергич. заболевания кожи.
В кач-ве микроэлемента В. входит в состав микроорганизмов, животных
и растений. Нек-рые организмы, напр. асцидии, лишайники, избирательно концентрируют
В.
Впервые В. был открыт в 1801 А. М. дель Рио. Однако позднее стали считать,
что за новый элемент принят Сг. Лишь в 1830 существование В. было твердо
установлено Н. Сефстрёмом и независимо от него Ф. Вёлером.
===
Исп. литература для статьи «ВАНАДИЙ»: Химия пятивалентного ванадия в водных растворах, Свердловск,
1971 (Труды института Химии УНЦ АН СССР, в. 24); Борисенко Л.Ф., Ванадий
(минералогия, геохимия и типы эндогенных месторождений), М., 1973; Химия
и технология редких и рассеянных элементов, под ред. К. А. Большакова,
2 изд., ч. 3, М., 1976, с. 3-37; Коган Б.И., Редкие металлы. Состояние
и перспективы, М., 1979, с. 168-202; Слотвински й-Сидак Н. П., Андреев
В. К., Ванадий в природе и технике, М., 1979; Аналитическая химия ванадия,
М., 1981. Б. Г. Коршунов.
Страница «ВАНАДИЙ» подготовлена по материалам химической энциклопедии.
|

