|
ВНУТРЕННЯЯ ЭНЕРГИЯ термодинамич. ф-ция состояния системы,
ее энергия, определяемая внутр. состоянием. В.э. складывается в осн. из
кинетич. энергии движения частиц (атомов, молекул, ионов, электронов) и
энергии взаимод. между ними (внутри- и межмолекулярной). На В.э. влияет
изменение внутр. состояния системы под действием внеш. поля; во В.э. входит,
в частности, энергия, связанная с поляризацией диэлектрика во внеш. электрич.
поле и намагничиванием парамагнетика во внеш. магн. поле. Кинетич. энергия
системы как целого и потенциальная энергия, обусловленная пространств.
расположением системы, во В.э. не включаются. В термодинамике определяется
лишь изменение В. э. в разл. процессах. Поэтому В. э. задают с точностью
до нек-рого постоянного слагаемого, зависящего от энергии, принятой за
нуль отсчета.
В.э. U как ф-ция состояния вводится первым началом термодинамики,
согласно к-рому разность между теплотой Q, переданной системе, и работой
W, совершаемой системой, зависит только от начального и конечного
состояний системы и не зависит от пути перехода, т.е. представляет изменение
ф-ции состояния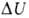
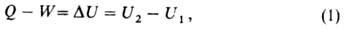
где U1 и U2 - В.э. системы в начальном
и конечном состояниях соответственно. Ур-ние (1) выражает закон сохранения
энергии в применении к термодинамич. процессам, т. е. процессам, в к-рых
происходит передача теплоты. Для циклич. процесса, возвращающего систему
в начальное состояние,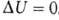 . В изохорных процессах, т.е. процессах при постоянном объеме, система
не совершает работы за счет расширения, W=0 и теплота, переданная
системе, равна приращению В.э.: Qv=
. В изохорных процессах, т.е. процессах при постоянном объеме, система
не совершает работы за счет расширения, W=0 и теплота, переданная
системе, равна приращению В.э.: Qv=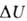 .
Для адиабатич. процессов, когда Q = 0, .
Для адиабатич. процессов, когда Q = 0,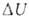 = - W.
= - W.
В.э. системы как ф-ция ее энтропии S, объема V и числа молей
mi i-того компонента представляет собой термодинамический
потенциал. Это является следствием первого и второго начал термодинамики
и выражается соотношением:
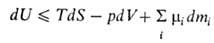 " "
где Т - абс. т-ра, р-давление,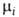 -хим.
потенциал i-того компонента. Знак равенства относится к равновесным процессам,
знак неравенства-к неравновесным. Для системы с заданными значениями S,
V, mi (закрытая система в жесткой адиабатной оболочке)
В.э. при равновесии минимальна. Убыль В. э. в обратимых процессах при постоянных
V и S равна макс. полезной работе (см. Максимальная работа
реакции). -хим.
потенциал i-того компонента. Знак равенства относится к равновесным процессам,
знак неравенства-к неравновесным. Для системы с заданными значениями S,
V, mi (закрытая система в жесткой адиабатной оболочке)
В.э. при равновесии минимальна. Убыль В. э. в обратимых процессах при постоянных
V и S равна макс. полезной работе (см. Максимальная работа
реакции).
Зависимость В.э. равновесной системы от т-ры и объема U =f(T, V)наз. калорическим уравнением состояния. Производная В.э. по т-ре при
постоянном объеме равна изохорной теплоемкости:
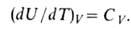
В.э. идеального газа от объема не зависит и определяется только т-рой.
Экспериментально определяют значение В.э. в-ва, отсчитываемое от ее
значения при абс. нуле т-ры. Определение В.э. требует данных о теплоемкости
СV(Т), теплотах фазовых переходов, об ур-нии состояния.
Изменение В.э. при хим. р-циях (в частности, стандартная В. э. образования
в-ва) определяется по данным о тепловых эффектах р-ций, а также по спектральным
данным. Теоретич. расчет В. э. осуществляется методами статистич. термодинамики,
к-рая определяет В.э. как среднюю энергию системы в заданных условиях изоляции
(напр., при заданных Т, V, mi). В.э. одноатомного идеального
газа складывается из средней энергии поступат. движения молекул и средней
энергии возбужденных электронных состояний; для двух- и многоатомных газов
к этому значению добавляется также средняя энергия вращения молекул и их
колебаний около положения равновесия. В.э. 1 моля одноатомного идеального
газа при т-рах порядка сотен К составляет 3RT/2, где R-газовая
постоянная; она сводится к средней энергии поступат. движения молекул.
Для двухатомного газа мольное значение В.э.-ок. 5RT/2 (сумма поступат.
и вращат. вкладов). Указанные значения отвечают закону равнораспределения
энергии для названных видов движения и вытекают из законов классич. статистич.
механики. Расчет колебат. и электронного вкладов во В.э., а также вращат.
вклада при низких т-рах требует учета квантовомех. закономерностей. В.э.
реальных систем включает помимо вкладов, учитываемых для идеального газа,
также среднюю энергию межмолекулярных взаимодействии.
===
Исп. литература для статьи «ВНУТРЕННЯЯ ЭНЕРГИЯ»: Ландау Л. Д., Лифшиц Е. М., Статистическая физика, 2 изд.,
М., 1964; Полторак О. М., Лекции по химической термодинамике, М., 1971;
Ка-рапетьянц М. X., Химическая термодинамика, 3 изд., М., 1975. Н. А.
Смирнова.
Страница «ВНУТРЕННЯЯ ЭНЕРГИЯ» подготовлена по материалам химической энциклопедии.
|

