|
ВОДОРОД (лат. Hydrogenium, от греч. hydor - вода и gennao - рождаю)
Н, первый, наиб. легкий хим. элемент периодич. системы Менделеева, ат.
м. 1,0794 + 0,0007 (второе слагаемое учитывает колебания изотопного состава).
Прир. В. состоит из двух стабильных изотопов: протия 1Н и дейтерия
2Н,
или D; содержание последнего (1,1-1,6)*10-3 ат. %; известен
также радиоактивный изотоп -тритий 3Н, или Т. Ядро атома
протия - протон. Атом В. имеет один электрон, занимающий 1s1-орбиталь;
степень окисления + 1 (наиб. распространена), — 1 (в гидридах щелочных
металлов). Энергия ионизации Н° -> Н+ 13,595 эВ; сродство к
электрону 0,75 эВ; электроотрицательность по Полингу 2,1; ат. радиус 0,046
нм.
Изотопы В. образуют двухатомные молекулы: Н2, HEX D2,
DT, НТ и Т2. Константа диссоциации Н2 2,56*10-34(300
К), 1,22*10-3 (2000 К); энергия диссоциации Н2
436
кДж/моль; межъядерное расстояние 0,07414 нм; осн. частота колебаний атомов
4405,30 см -1, поправка на ангармоничность 125,32 см
-1.
Содержание В. в земной коре (литосфере и гидросфере) 1% по массе,
или 16 ат.%, в атмосфере -10-4 ат.%. В природе В. распространен
чаще всего в виде соед. с О, С, S, N и С1, реже - с Р, I, Вr и др. элементами;
он входит в состав всех растительных и животных организмов, нефти, ископаемых
углей, прир. газа, воды, ряда минералов и пород (в форме гидратов). В своб.
состоянии на Земле встречается очень редко (в небольших кол-вах - в вулканич.
газах и продуктах разложения орг. остатков). В. - самый распространенный
элемент Вселенной; в виде плазмы он составляет ок. половины массы Солнца
и большинства звезд, осн. часть газа межзвездной среды и газовых туманностей.
Свойства. В. - бесцв. газ без вкуса и запаха; плотность при 273,15
К и атм. давлении 0,0899 кг/м3 (0,0695 по отношению к воздуху);
мольный объем 22,43 м3/кмоль. Коэф. сжимаемости (pv/RT)при
273,15 К : 1,0006 (0,1013 МПа), 1,0124 (2,0266 МПа), 1,0644 (10,133 МПа),
1,134 (20,266 МПа), 1,277 (40,532 МПа); С°р 14,235 кДж/(кг*К),
С? 10,090 кДж/(кг*К); ур-ние температурной зависимости Сp° в
интервале 298-3000 К: С° = 4,1868(6,52 + 0,78*10-3 Т+ +
0,12*105/Т2) Дж/(моль*К);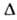 Нoсгор-143,06
МДж/кг; температурный коэф. объемного расширения 3658,8*10-1
К-1 в интервале 273-373 К; Нoсгор-143,06
МДж/кг; температурный коэф. объемного расширения 3658,8*10-1
К-1 в интервале 273-373 К;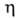 газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа
п589,3
1,000132.
газа 0,88-10" 5 Па*с (293,15 К); показатель преломления газа
п589,3
1,000132.
В. быстрее др. газов распространяется в пространстве, проходит через
мелкие поры, при высоких т-рах сравнительно легко проникает сквозь сталь
и др. материалы.
Обладает высокой теплопроводностью, равной при 273,15 К и 1013 гПа 0,1717
Вт/(м*К) (7,3 по отношению к воздуху); ур-ние температурной зависимости
теплопроводности: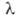 =
0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К). =
0,1591 (367/T + 94)(Т/273)3/2 Вт/(м*К).
Р-римость В.: в воде при 273,15 К и атм. давлении -0,0215% по объему;
при 298,15 К и 10,133 МПа в воде - 1,73 см3/г, в метаноле -
11,0 см3/г. В. хорошо раств. во мн. металлах, лучше всего в
Pd (в одном объеме Pd раств. 850 объемов В.). Губчатое железо при 0,1013
МПа и 973 К поглощает 0,14, а при 1173 К - 0,37 объемов В. на 1 объем металла.
В. может находиться в орто- и пара-состояниях. Ортоводород (о-Н2)
имеет параллельную (одного знака) ориентацию ядерных спинов, параводород
(п-Н2) - антипараллельную. Это обусловливает нек-рое различие
магнитных, оптич. и термич. св-в указанных модификаций. При обычных и высоких
т-рах Н2 (нормальный В., н-Н2) представляет собой
смесь 75% орто- и 25% пара-модификаций, к-рые могут взаимно превращаться
друг в друга (орто-пара-превращение). Различают также равновесный В. (р-Н2),
имеющий равновесный орто-пара-состав для данной т-ры (табл. 1). При превращ.
о-Н2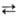 п-Н2
выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов
В. п-Н2
выделяется тепло (1418 Дж/моль). Такое превращ. характерно и для др. изотопов
В.
Табл. 1.-СОСТАВ РАВНОВЕСНОГО ВОДОРОДА И ТЕПЛОТА ПРЕВРАЩЕНИЯ н-Н2->р-Н2

Самопроизвольное орто-пара-превращение В. при низкой т-ре происходит
очень медленно, что позволяет получать жидкий В., близкий по орто-пара-составу
к н-Н2, хотя термодинамически устойчив при этих условиях только
п-Н2. Орто-пара-превращение ускоряется в присут. катализаторов
(активного угля, оксидов и гидроксидов ряда металлов, в т. ч. РЗЭ, и др.).
Нек-рые св-ва модификаций В. приведены в табл. 2, св-ва жидкого В.- в табл.
3.
Табл. 2-СВОЙСТВА МОДИФИКАЦИЙ ВОДОРОДА

Табл. 3.-СВОЙСТВА ЖИДКОГО ВОДОРОДА
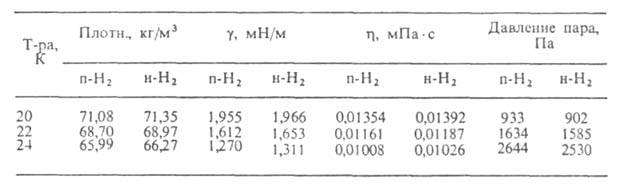
Теплоемкость жидкого В. мало зависит от орто-пара-состава; ур-ние температурной
зависимости: С? = 6,86 + + 0,66*10-4 T + 0,279*10-6 Т2
кДж/(кг*К); ур-ние температурной зависимости теплопроводности жидкого В.
под давлением паров (независимо от орто-пара-состава):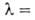 =1,16(1,70+ 0,0557Т)*10-4 Вт/(м*К); показатель преломления
n435,9 1,1118 при 20,33 К.
=1,16(1,70+ 0,0557Т)*10-4 Вт/(м*К); показатель преломления
n435,9 1,1118 при 20,33 К.
Ур-ние температурной зависимости давления пара над жидким и твердым
В.: lgO,0075p (Па) = А - В/Т + СТ (значения А, В и С приведены
в табл. 4).
Табл. 4.-ЗНАЧЕНИЯ КОЭФФИЦИЕНТОВ А, В, С В УРАВНЕНИИ ТЕМПЕРАТУРНОЙ
ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА Н2

Твердый В. кристаллизуется в гексагон. решетке (а = = 0,378 нм, с =
0,6167 нм), в узлах к-рой расположены молекулы Н2, связанные
между собой слабыми межмол. силами; плотн. 86,67 кг/м3; С° 4,618
Дж/(моль*К) при 13 К; диэлектрик. При давлении свыше 10000 МПа предполагается
фазовый переход с образованием структуры, построенной из атомов и обладающей
металлич. св-вами. Теоретически предсказана возможность сверхпроводимости
"металлич. В.".
В. в обычном состоянии при низких т-рах мало активен, без нагревания
реагирует лишь с F2 и на свету с С12. С неметаллами
В. взаимод. активнее, чем с металлами. С кислородом реагирует практически
необратимо, образуя воду с выделением 285,75 МДж/моль тепла; в присут.
катализаторов (Pt, Pel, Ni) эта р-ция идет достаточно быстро при 80-130
°С. С азотом в присут. катализатора при повышенных т-рах и давлениях В.
образует аммиак, с галогенами -галогеноводороды, с халькогенами - гидриды:
H2S (выше 600 °С), H2Se (выше 530 °С) и Н2Те
(выше 730 °С). С углеродом В. реагирует только при высоких т-рах, образуя
углеводороды. Практич. значение имеют р-ции В. с СО, при к-рых в зависимости
от условий и катализатора образуются метанол или (и) др. соединения. Со
щелочными и щел.-зем. металлами, элементами III, IV, V и VI гр. периодич.
системы, а также с интерметаллич. соед. В. образует гидриды. В. восстанавливает
оксиды и галогениды мн. металлов до металлов, ненасыщ. углеводероды - до
насыщенных (см. Гидрирование). В. легко отдает свой электрон, в
р-ре отрывается в виде протона от многих соед., обусловливая их кислотные
св-ва. В водных р-рах Н+ образует с молекулой воды ион гидроксония
Н3О . Входя в состав молекул различных соед., В. склонен образовывать
со многими электроотрицат. элементами (F, О, N, С, В, Cl, S, Р) водородную
связь.
Получение. Осн. виды сырья для пром. произ-ва В. - прир. газ,
жидкие и твердые горючие ископаемые, вода. наиб. кол-во В. получают паровой
конверсией прир. газа, включающей след. стадии.
1) Каталитич. конверсию газа с водяным паром:
СН4 + Н2О -> СО + ЗН2 - 206 кДж
Осуществляется в присут. Ni на А12О3 при 750-870
°С в трубчатых реакторах. Для наружного обогрева стальных трубок реактора
часть прир. газа сжигают. По др. способу в смесь газа с водяным паром добавляют
О2 (0,55 — 0,65 м3 на 1 м3 СН4),
благодаря чему конверсия СН4 становится автотермичной (в результате
экзотермич. р-ции: СН4 + 1/2О2->
СО + 2Н2 + 35,6 кДж) и не требует наружного обогрева реактора.
Этот процесс осуществляют в реакторах шахтного типа при 830-1000°С.
2) Конверсию СО с водяным паром: СО + ЗН2 + Н2О
-> СО2 + 4Н2 + 41 кДж; процесс проводят при 370-440
°С в присут. железохромового кат. (первая ступень) и при 230-260 °С в присут.
цинкхроммедного кат. (вторая ступень).
3) Очистку газовой смеси от СО2 и остатков непрореагировавших
СО, СН4 и Н2О осуществляют обычными методами (см.
Газов
очистка).
Известен также способ высокотемпературной (1350-1450 °С) конверсии газообразных
углеводородов, основанный на их неполном окислении кислородом до СО в своб.
объеме без катализатора. Дальнейшие стадии конверсии СО и очистки газовой
смеси аналогичны применяемым в первом способе.
Получение В. из твердых горючих ископаемых включает их переработку с
водяным паром и воздухом или О2 (газификацию): С + Н2О
-> СО + Н2 - 118,9 кДж; 2С + О2 -> 2СО + 230 кДж.
В результате образуется водяной газ (содержащий до 40% СО и 50% Н2),
а также СО2, СН4, N2 и примеси сернистых
соединений. После очистки от последних получают В., как указано в первом
способе. Аналогично перерабатывают и тяжелые нефтяные остатки.
Газ, содержащий 85-90% В. и 10-15% др. газов, гл. обр. углеводородов,
получают в кач-ве побочного продукта на нефтеперерабатывающих заводах (см.
Газы
нефтепереработки). Из газа коксовых печей, содержащего 55-60% В., последний
выделяют методом фракц. конденсации при глубоком охлаждении (см. Газов
разделение).
Сравнительно небольшое кол-во В. (и одновременно О2) получают
электролизом воды. Электролитом служит водный р-р КОН (350-400 г/л); давление
в электролизерах от атмосферного до 4 МПа, их производительность 4-500
м3/ч, расход электроэнергии 5,1-5,6 кВт*ч на 1 м3
В. (теоретич. расход при 25 °С 2,94 кВт*ч). Разрабатываются высокотемпературные
процессы электролита ч. разложения воды (с целью снижения расхода электроэнергии
и уменьшения объема аппаратуры). значит. кол-ва В. образуются в кач-ве
побочного продукта при электролитич. произ-ве С12 и щелочей,
хлоратов, Н2О2.
Перспективные методы получения В. - термохим. и термоэлектрохим. циклы
разложения воды с использованием тепла, выделяемого в атомных реакторах
(см. Водородная энергетика). В этих циклах все компоненты системы,
кроме воды, полностью регенерируются.
Производится также жидкий п-Н2. Для этого В. тщательно очищают
от всех примесей, в т. ч. от О2 (до содержания менее 1*10-9
объемных долей), охлаждают жидким N2, сжижают путем дросселирования
и расширения газа в детандере и осуществляют орто-пара-превращение В. в
присут. катализаторов. Расход энергии составляет 72-105 МДж на 1 кг жидкого
В. Мощность установок по произ-ву жидкого В. в США превышает 155 т/сут.
Атомарный В. образуется из молекулярного при термич. диссоциации, под
действием электрич. разрядов, излучения с длиной волны менее 85 нм и при
воздействии медленных электронов.
Определение. В составе газовых смесей В. определяют методами
хроматографии, масс-спектрометрии, каталитич. сжиганием с послед. определением
кол-ва образовавшейся воды, по уменьшению объема и тепловому эффекту, измерением
теплопроводности газовой смеси.
Применение. Газообразный В. применяют для синтеза NH3,
CH3OH, высших спиртов, углеводородов, НС1 и др., как восстановитель
при получении мн. орг. соединений, в т.ч. пищ. жиров. В металлургии В.
используют для получения металлов, создания защитной среды при обработке
металлов и сплавов, в нефтепереработке - для гидроочистки нефтяных фракций
и смазочных масел, гидрирования и гидрокрекинга нефтяных дистиллатов, нефтяных
остатков и смол. В. применяют также в произ-ве изделий из кварцевого стекла
и др. с использованием водородно-кислородного пламени (т-ра выше 2000°С),
для атомно-водородной сварки тугоплавких сталей и сплавов, для охлаждения
турбогенераторов, как восстановитель в топливных элементах.
Жидкий В. применяется как горючее в ракетной и космич. технике, для
заполнения пузырьковых камер, в кач-ве хладагента в криогенных конденсационных
и адсорбционных вакуум-насосах.
В 1980 в США расход В. составил (% к общему потреблению): на синтез
NH3 - 26, синтез СН3ОН - 3,3, гидрокрекинг - 34,7,
гидроочистку нефтепродуктов - 21, нефтехим. синтез - 3,5.
В. нетоксичен, но пожаро- и взрывоопасен; т-ра взрывного самовоспламенения
в воздухе 577 °С; КПВ в воздухе 4-75%, в О2-4,65-96% по объему.
Жидкий В. при попадании на открытые участки тела может вызвать сильное
обморожение. Газообразный В. хранят в мокрых и сухих газгольдерах, емкостях
высокого давления и транспортируют по трубопроводам; малые кол-ва хранят
и транспортируют в стальных баллонах под давл. до 20 МПа. Разрабатываются
проекты подземного хранения больших кол-в В. в выработанных месторождениях
нефти и газа, горных выработках, искусств. соляных кавернах. Жидкий В.
хранят и транспортируют в спец. герметич. резервуарах с эффективной тепловой
изоляцией; сосуды емкостью от 15 до 75 л могут иметь экран из жидкого N2.
Емкость автомобильных прицепов и полуприцепов 25-75 м3, железнодорожных
цистерн 100-125 м3, стационарных хранилищ - до 3000 м3.
Ведутся разработки в области техники получения и хранения В. в твердом
и шугообразном (до 50% твердой фазы) состоянии. В. можно хранить и транспортировать
в виде твердых гидридов металлов и интерметаллич. соед., способных поглощать
и отдавать при нагр. неск. сотен объемов В. на единицу своей массы. Мировое
произ-во В. свыше 30 млн. т/год (1980).
В. был открыт в 1-й пол. 16 в. Парацельсом. В 1776 Г. Кавендиш впервые
исследовал его св-ва, в 1783-1787 А. Лавуазье показал, что В. входит в
состав воды, включил его в список хим. элементов и предложил название "гидроген".
===
Исп. литература для статьи «ВОДОРОД»: Письмен М. К., Производство водорода в нефтеперерабатывающей промышленности,
М., 1976; Жидкий водород, М., 1980; Водород в металлах, пер. с англ., т.
1-2, М., 1981. Я. Д. Зельвенский.
Страница «ВОДОРОД» подготовлена по материалам химической энциклопедии.
|

