|
ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ, энергетич. состояния атомов
и молекул и др. квантовых систем, характеризующиеся избыточной по сравнению
с осн. состоянием энергией. Согласно принципам квантовой механики, атомы
и молекулы устойчивы лишь в нек-рых стационарных состояниях, к-рым отвечают
определ. значения энергии. Состояние с наинизшей энергией наз. основным,
остальные -возбужденными. Изменение энергии атома при переходе из одного
стационарного состояния в другое связано с изменением строения его электронной
оболочки (см. Атом).
В молекулах при таком переходе может меняться как электронное состояние,
связанное с движением электронов относительно атомных ядер, так и характер
колебат. и вращат. движений, в к-рых участвуют сами ядра (см. Молекула).
В т. наз. приближении Борна - Оппенгеймера рассматривают каждый вид
молекулярного движения в отдельности и находят волновые ф-ции и соответствующие
значения энергии для электронного, колебат. и вращат. движений; полная
волновая ф-ция молекулы представляется в виде произведения соответствующих
волновых ф-ций (см. Адиабатическое приближение). Однако не всегда
можно достаточно точно разделить электронное, колебат. и вращат. движения.
Кроме энергии, состояния атомов и молекул могут различаться спином (электронным
и ядерным); частицы в разл. спиновых состояниях имеют почти одинаковые
энергии в отсутствие магн. поля, но при наложении поля напряженностью Я
их энергии изменяются по-разному.
Переходы между разл. стационарными состояниями атомов и молекул, происходящие
с поглощением или испусканием электромагн. излучения, наз. излучательными,
а происходящие путем непосредств. обмена энергией между атомами или молекулами
- безызлучательными. Энергетику и вероятности излучат. переходов изучает
спектроскопия.
B.C. могут терять избыток энергии, переходя в основное состояние (или
нижележащие B.C.) путем испускания фотонов, безызлучат. резонансного переноса
энергии или при столкновениях с др. молекулами. Поэтому B.C. имеют огранич.
время жизни, определяемое суммой констант скорости всех процессов дезактивации.
В многоатомных молекулах происходят внутримолекулярные процессы перераспределения
энергии между разл. видами возбуждения. В равновесных условиях при данной
т-ре заселенность разл. состояний зависит от их энергии в соответствии
с распределением Максвелла - Больцмана. При т-рах порядка неск. сот К заселены
гл. обр. самые нижние электронное и колебат. состояния, а вращат. и спиновые
состояния заселены почти равномерно. Под действием излучения соответствующей
частоты возникает сверхравновесная концентрация B.C., зависящая от интенсивности
поглощаемого света и времени жизни (времени релаксации) B.C.
Возбужденные состояния атомов. Образуются из основного состояния
при переходе одного или неск. электронов (напр., под действием излучения)
с занятых орбиталей на свободные (или занятые лишь одним электроном). Наим.
энергиями обладают В. с., связанные с переходами во внешних или между внешними
электронными оболочками. Более высокие B.C. возникают при переходе электронов
с внутр. оболочек многоэлектронных атомов на внешние (напр., под действием
рентгеновского излучения).
Электронные уровни атомов и молекул определяются совокупностью квантовых
чисел. Электронные состояния атомов обозначают латинскими буквами S,
P, D, F, G, ..., отвечающими значениям орбитального квантового числа
L = О, 1, 2, 3, 4, ... соотв., указывая мультиплетность состояния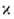 = 2S+1 (S-спиновое квантовое число) численным индексом слева вверху,
а квантовое число полного углового момента
= 2S+1 (S-спиновое квантовое число) численным индексом слева вверху,
а квантовое число полного углового момента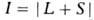 -справа внизу. Напр., B.C. атома ртути, имеющие L=l, / = 1, S = О и 1 соотв.
обозначают 1Р1 и 3P1.
-справа внизу. Напр., B.C. атома ртути, имеющие L=l, / = 1, S = О и 1 соотв.
обозначают 1Р1 и 3P1.
Энергия электрона Е в атоме водорода зависит только от главного
квантового числа п (в системе СИ):
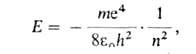
где т и е-масса и заряд электрона, h-постоянная Планка,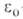 -электрич. постоянная (диэлектрич. проницаемость вакуума). Энергия многоэлектронных
атомов зависит от всех квантовых чисел.
-электрич. постоянная (диэлектрич. проницаемость вакуума). Энергия многоэлектронных
атомов зависит от всех квантовых чисел.
Возбужденные состояния молекул. Колебат. и вращат. B.C. играют
чрезвычайно важную роль в термич. хим. р-циях (см. Динамика элементарного
акта р-ции); информацию о строении и св-вах этих состояний дают соответствующие
спектры (см. Колебательные спектры. Вращательные спектры). Р-ции,
протекающие через высшие колебат. B.C., получаемые путем многократного
поглощения фотонов одной и той же молекулой, изучает лазерная химия.
Электронные B.C. отличаются от остальных тем, что характеризуют совершенно
иное электронное строение молекул и их хим. св-ва. Эти B.C. определяют
протекание фотохим., а также нек-рых радиационно-хим. и плазмохим. р-ций.
B.C., обладающие одновременно избыточной электронной и колебат. энергией,
наз. вибронными состояниями. В данной статье рассмотрена классификация
и особенности электронных B.C. молекул.
Для двухатомных молекул, как и для атомов, удается использовать классификацию
электронных состояний, основанную на квантовых числах. Электронные состояния
молекул, обладающие квантовым числом полного орбитального момента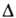 =0,
1, 2, ... обозначают соотв. греческими буквами =0,
1, 2, ... обозначают соотв. греческими буквами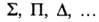 , указывая мультиплетность состояния индексом слева вверху, а сумму квантовых
чисел
, указывая мультиплетность состояния индексом слева вверху, а сумму квантовых
чисел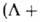 + +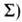 -компоненту
мультиплета - справа внизу ( -компоненту
мультиплета - справа внизу (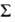 -квантовое
число проекции электронного спина на ось молекулы). -квантовое
число проекции электронного спина на ось молекулы).
Электронные B.C. многоатомных молекул классифицируют, основываясь на
св-вах симметрии их электронных волновых ф-ций или характере молекулярных
орбиталей, занятых "холостыми" электронами, поскольку понятие квантовых
чисел электронов для таких молекул теряет простой смысл. Св-ва симметрии
электронных волновых ф-ций молекул обозначают в соответствии с теорией
групп симметрии. Так, для молекул Н2СО, Н2О, относящихся
к группе симметрии C2V, существует 4 возможных типа симметрии
волновой ф-ции (A1, A2, В1 и В2)в зависимости от того, сохраняется или меняется ее знак при операциях
симметрии, свойственных данной группе. Помимо обозначения типа симметрии,
индексом слева вверху указывают мультиплетность состояния. Буквы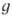 и и в правом ниж. индексе показывают, сохраняется или меняется знак
волновой ф-ции при операции инверсии. Необходимо отметить, что такая классификация
в неявном виде предполагает сохранение в B.C. молекулы геометрии ее основного
состояния. Это справедливо в общем виде лишь при рассмотрении спектров
поглощения, когда выполняется принцип Франка-Кондона. На самом же деле
у мн. молекул равновесная конфигурация ядер в В. с. может сильно отличаться
от конфигурации в основном состоянии (примеры см. ниже).
и и в правом ниж. индексе показывают, сохраняется или меняется знак
волновой ф-ции при операции инверсии. Необходимо отметить, что такая классификация
в неявном виде предполагает сохранение в B.C. молекулы геометрии ее основного
состояния. Это справедливо в общем виде лишь при рассмотрении спектров
поглощения, когда выполняется принцип Франка-Кондона. На самом же деле
у мн. молекул равновесная конфигурация ядер в В. с. может сильно отличаться
от конфигурации в основном состоянии (примеры см. ниже).
В сложных молекулах, обладающих малым числом элементов симметрии, ограничиваются
указанием типов молекулярных орбиталей, содержащих неспаренные электроны.
В орг. молекулах орбитали классифицируют на связывающие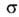 ,
связывающие ,
связывающие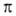 (делокализованные в ароматич. и сопряженных системах), разрыхляющие
(делокализованные в ароматич. и сопряженных системах), разрыхляющие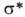 и
и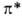 , несвязывающие
орбитали своб. пар электронов гетероатомов и (ортогональные , несвязывающие
орбитали своб. пар электронов гетероатомов и (ортогональные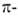 системе)
и l (сопряженные с системе)
и l (сопряженные с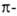 системой),
а также вакантные орбитали и, имеющиеся у нек-рых гетероатомов (напр.,
у В). В большинстве орг. молекул, содержащих четное число электронов, в
основном состоянии все электроны спарены, и оно является синглетным (исключением
являются, напр., карбен и его производные, основное состояние к-рых триплетно).
При возбуждении один из электронов переходит с занятой (чаще всего связывающей
или несвязывающей) орбитали на одну из свободных (разрыхляющую или вакантную).
Так, B.C. формальдегида относятся к типам системой),
а также вакантные орбитали и, имеющиеся у нек-рых гетероатомов (напр.,
у В). В большинстве орг. молекул, содержащих четное число электронов, в
основном состоянии все электроны спарены, и оно является синглетным (исключением
являются, напр., карбен и его производные, основное состояние к-рых триплетно).
При возбуждении один из электронов переходит с занятой (чаще всего связывающей
или несвязывающей) орбитали на одну из свободных (разрыхляющую или вакантную).
Так, B.C. формальдегида относятся к типам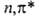 и
и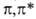 (в
обозначениях теории групп это состояния А2 и А1
соотв.). Простейший способ обозначения B.C., не требующий знания их
природы, заключается в их нумерации в порядке возрастания энергии: основное
S0 (для молекул с четным числом электронов), возбужденные синглетные
51, S2 и т.д., триплетные T1,Т2
и т.д. (в
обозначениях теории групп это состояния А2 и А1
соотв.). Простейший способ обозначения B.C., не требующий знания их
природы, заключается в их нумерации в порядке возрастания энергии: основное
S0 (для молекул с четным числом электронов), возбужденные синглетные
51, S2 и т.д., триплетные T1,Т2
и т.д.
В B.C. спины неспаренных электронов м.б. как антипараллельными, так
и параллельными. В молекулах с четным числом электронов, т. обр., имеется
два набора В. с., различающихся по мультиплетности, - синглетные и триплетные.
При этом синглетные и триплетные состояния одной природы имеют разл. электронные
волновые ф-ции. Согласно Паули принципу, полная волновая ф-ция является
антисимметричной, т.е. меняет знак при перестановке координат двух электронов.
Синглетные состояния имеют антисимметричную спиновую и симметричную пространств.
волновые ф-ции, а триплетные-симметричную спиновую и антисимметричную пространственную.
Вследствие электростатич. отталкивания электронов между собой энергия состояния
с симметричной пространств. волновой ф-цией (синглетно-го) выше энергии
состояния с аналогичной антисимметричной пространств. волновой ф-цией (триплетного),
соответствующего той же электронной конфигурации. В молекулах с нечетным
числом электронов соотв. имеются наборы дублетных и квартетных В. с.
В координац. соединениях переходных металлов атомные орбитали центр,
иона взаимод. с орбиталями лигандов с образованием молекулярных орбиталей
комплекса. В зависимости от симметрии комплексов нек-рые атомные орбитали
сохраняют свою энергию и остаются вырожденными. Поэтому в основном состоянии
могут реализоваться т. наз. высокоспиновые состояния ионов, когда неск.
электронов с одинаковыми спинами расположены по одному на вырожденных атомных
орбиталях. В. с. координац. соединений получаются в результате перехода
электронов молекулярных орбиталей лиганда на вакантные атомные орбитали
металла (состояния переноса заряда лиганд - металл -LUCT), с атомных
орбиталей иона металла на вакантные молекулярные орбитали лигандов (состояния
переноса заряда металл-лиганд-MLCT), между атомными орбиталями иона металла
или между молекулярными орбиталями лигандов. Электронные B.C. координац.
соединений также обозначают, основываясь на теории групп симметрии, в соответствии
со св-вами симметрии электронной волновой ф-ции.

Изменение электронной структуры атомов и молекул при переходе из основного
в В. с. приводит к изменению их геометрии, т.е. равновесных расстояний
между атомами в молекулах, дипольных моментов и поляризуемости, хим. св-в.
Электронные В. с. могут быть стабильными или диссоциативными (нестабильными).
Для первых характерно наличие полного минимума на поверхности потенциальной
энергии, для вторых - монотонное понижение энергии при увеличении расстояния
между к.-л. атомами или атомными группами. Изменение структуры молекулы
при переходе в B.C. можно проиллюстрировать на примере формальдегида. Его
основное состояние является плоским, длина связи С—О составляет 0,122 нм.
Синглетное и триплетное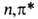 В. с. - пирамидальные с углом между С—О связью и плоскостью СН2-группы
20 и 35° соотв.; длина С—О связи увеличивается до 0,132 и 0,131 нм; дипольный
момент молекулы в основном состоянии 2,ЗD, в возбужденном син-глетном-1,6D.
В. с. - пирамидальные с углом между С—О связью и плоскостью СН2-группы
20 и 35° соотв.; длина С—О связи увеличивается до 0,132 и 0,131 нм; дипольный
момент молекулы в основном состоянии 2,ЗD, в возбужденном син-глетном-1,6D.
Потенциалы ионизации (первые) молекул и атомов в В. с. уменьшаются на
величину энергии возбуждения, а сродство к электрону возрастает на ту же
величину, поскольку при ионизации или присоединении электрона образуются
ионы в основном электронном состоянии. Т. обр., при возбуждении возрастают
как электронодонорные, так и электроноакцепторные св-ва. Характер изменения
кислотно-основных св-в при возбуждении зависит от соотношения энергий возбуждения
к-ты и сопряженного основания, поскольку при р-циях переноса протона электронное
возбуждение в большинстве случаев сохраняется. Так, для фенола величина
рК уменьшается от 10,0 до 4,1 при возбуждении в нижнее синглетное состояние
и до 8,5 при возбуждении в триплетное состояние, а для бензойной к-ты рК
возрастает с 4,2 до 9,5 при возбуждении в синглетное состояние. Энергии
диссоциации связей также изменяются. Поскольку в B.C. электрон оказывается
на разрыхляющей орбитали, энергии связей обычно уменьшаются и даже могут
становиться отрицательными для диссоциативных состояний. Содержащие непарный
электрон на несвязывающей орбитали B.C.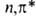 -типа
обладают, подобно радикалам, способностью отрывать атомы водорода от др.
молекул. -типа
обладают, подобно радикалам, способностью отрывать атомы водорода от др.
молекул.
Сильное изменение электронного строения и хим. св-в молекул и атомов
при переходе в B.C. обусловливает возможность протекания фотохим. р-ций.
Ввиду малого времени жизни B.C. (~ 10-8 с для типичных синглетных
B.C. и ~10-5с для триплетных состояний в жидких р-рах) эффективно
протекают только очень быстрые р-ции, обладающие малыми энергиями активации.
===
Исп. литература для статьи «ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ»: Герцберг Г., Электронные спектры и строение многоатомных
молекул, пер. с англ., М., 1969; Барлтроп Дж., Койл Дж., Возбужденные состояния
в органической химии, пер. с англ., М., 1978; Окабе X., Фотохимия малых
молекул, пер. с англ., М., 1981. См. также лит. при статьях Лазерная
химия, Плазмохимия, Радиационная химия, Фотохимия. М. Г. Кузьмин.
Страница «ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ» подготовлена по материалам химической энциклопедии.
|

