|
ВИЛЬЯМСОНА СИНТЕЗ, получение простых эфиров (обычно несимметричных)
алкилированием алкоголятов или фенолятов алкилгалогенидами:
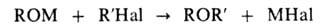
Для синтеза алифатич. эфиров смесь алкоголята с R'Hal кипятят без р-рителя
или в р-рителе, индифферентном к реагентам (напр., в эфире, толуоле, ксилоле).
Используют также спиртовые р-ры КОН или алкоголятов.
Для синтеза алкилариловых эфиров кипятят смесь небольшого избытка AlkHal
и фенолята в спиртовом р-ре. В кач-ве р-рителя используют также воду, ацетон,
этилацетат, диоксан, толуол, ксилол, хлорбензол. Углеводы О-метилируют
в жидком NH3 действием Na, затем СН31.
Р-ритель часто оказывает решающее влияние на выход продуктов р-ции.
Напр., высокий выход эфиров из орто-и пара-гидроксибифенилов достигается
при проведении р-ции в ацетоне; в спирте же выходы крайне низкие. Обычно
выходы арилалкиловых эфиров с первичными и вторичными алкильными радикалами
составляют 80-90%. Как диалкиловые, так и алкилариловые эфиры часто удобно
синтезировать в условиях межфазного катализа. Для повышения скорости р-ции
при использовании RBr и RC1 в реакционную смесь добавляют Nal в кол-ве
0,1-0,2 эквивалента.
В качестве побочных продуктов в р-ции образуются олефины:
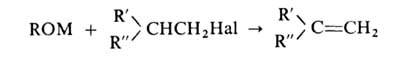
Их кол-во возрастает в зависимости от структуры AlkHal в ряду: первичные
< вторичные < третичные. Поэтому при получении эфира, содержащего
разветвленный радикал, следует выбирать такую комбинацию реагентов, чтобы
разветвленный радикал входил в состав молекулы алкоголята. Для уменьшения
выхода олефинов целесообразно также снижение т-ры р-ции и использование
менее реакционноспособных алкоголятов (напр., магниевых) и алкилгалогенидов
(хлоридов и бромидов вместо иодидов).
Получение алкилариловых эфиров часто сопровождается алкилированием бензольного
кольца (С-алкилирование). Эта р-ция особенно характерна для многоосновных
фенолов, содержащих ОН-группы в мета-положениях. Направление этой р-ции
существенным образом зависит от р-рителя: в спирте, ацетоне, ДМФА, ДМСО
преобладает О-алкилирование (т.е. образование простых эфиров), в водных
р-рах, а также в менее полярных р-рителях, таких, как бензол, толуол, -
С-алкилирование. Для уменьшения доли продукта С-алкилирования р-цию проводят
в слабощелочной среде.
B.C. осуществляется обычно по механизму бимолекулярного нуклеоф. замещения.
В случае третичных RHal преобладает мономолекулярное нуклеоф. замещение
и элиминирование.
В модификациях B.C. в качестве алкилирующих агентов применяют диалкилсульфаты,
что особенно удобно для алкилирования реакционноспособных спиртов (напр.,
бензилового, аллилового, коричного), углеводов и фенолов. Из др. алкилирующих
агентов используют эфиры муравьиной к-ты, ортоэфиры и эфиры арил- и алкилсульфокислот,
соли триалкилоксония. Для алкилирования гидроксикислот применяют алкилиодиды
в присут. Ag2O или ВаО. Удобный метод синтеза PhOR - алкилирование
фенолов в р-ре ацетона в присут. поташа (этот синтез наз. р-цией Клайзена).
Р-ция открыта А. Вильямсоном в 1851.
===
Исп. литература для статьи «ВИЛЬЯМСОНА СИНТЕЗ»: Вебер В., ГокельГ., Межфазный катализ в органическом синтезе,
пер. с англ., М., 1980, с. 97-110; Бюлер К., Пирсон Д., Органические синтезы,
пер. с англ., ч. 1, М., -J973, с. 326-373; Н ouben-Wey I, Methoden der
organischen Chemie, 4 Aufl, Bd 6, Tl 3, Stuttg., 1965; Wang Chin-Hsien
[a.o.], "Synthesis", 1982, N 10, p. 8581. Г. А. Артамкина.
Страница «ВИЛЬЯМСОНА СИНТЕЗ» подготовлена по материалам химической энциклопедии.
|

