|
ВОЛЬФРАМА ГЕКСАФТОРИД WF6, бесцв. газ, дымящий и синеющий
во влажном воздухе; т. пл. 2,0 °С, т. кип. 17,3°С; плотн. 3,99 г/см3;
С° 120,5 Дж/(моль*К);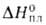 4,1 кДж/моль,
4,1 кДж/моль,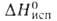 26,4 кДж/моль,
26,4 кДж/моль,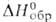 -1721,5 кДж/моль,
-1721,5 кДж/моль,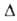 Gобр
- 1635,9 кДж/моль; So298 353,5 Дж/(моль*К).
Ниже — 8,5 °С образует кристаллы с ромбич. решеткой [а = 0,9603 нм, b
= 0,8713 нм, с = = 0,5044 нм, z = 4, пространств. группа Рпта,
плотн. 4,75 г/см3 (-183°С)], выше - 8,5°С - кристаллы с
кубич. решеткой [а = 0,628 нм, z = 2, плотн. 3,99 г/см3
(О °С)]; Gобр
- 1635,9 кДж/моль; So298 353,5 Дж/(моль*К).
Ниже — 8,5 °С образует кристаллы с ромбич. решеткой [а = 0,9603 нм, b
= 0,8713 нм, с = = 0,5044 нм, z = 4, пространств. группа Рпта,
плотн. 4,75 г/см3 (-183°С)], выше - 8,5°С - кристаллы с
кубич. решеткой [а = 0,628 нм, z = 2, плотн. 3,99 г/см3
(О °С)];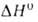 перехода
8,7 кДж/моль. Ур-ния температурной зависимости давления пара над жидким
WF6: перехода
8,7 кДж/моль. Ур-ния температурной зависимости давления пара над жидким
WF6:

WF6 сильно гигроскопичен, гидролизуется водой; хорошо раств.
в перфторциклопентане и жидком HF (11,5% при — 5°С); образует с HF азеотропную
смесь. С фторидами щелочных металлов и аммония, NOF, NO2F В.
г. дает комплексные соединения, содержащие ионы WF7-
или WF82-. При нагр. восстанавливается водородом, углеводородами,
Si, W и др. металлами до W.
Получают WF6 взаимод. W (реже WO3) с F2
при 300-450 °С. Применяют для нанесения покрытий из W на графит, Si и металлы,
в произ-ве карбидов W, порошкообразного W, изделий из W и его сплавов с
Mo, Re и др. металлами хим. осаждением из газовой фазы, для разделения
изотопов W.
В. г. токсичен, ПДК 0,5 мг/м3 в пересчете на HF.
===
Исп. литература для статьи «ВОЛЬФРАМА ГЕКСАФТОРИД»: Фторидный процесс получения вольфрама. Физико-химические
основы. Свойства металлов, М., 1981. Э. Г. Раков.
Страница «ВОЛЬФРАМА ГЕКСАФТОРИД» подготовлена по материалам химической энциклопедии.
|

