|
АКРИЛОНИТРИЛ (нитрил акриловой к-ты, 2-пропеннитрил, винилцианид)
CH2=CHCN, мол. м. 53,06; бесцв. жидкость с резким запахом; т.
затв. — 83,55°С, т. кип. 77,3°С; d420 0,8064,
nD20
1,3914;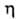 0,40 мПа*с (20°С), 0,25 мПа*с (60°С); давление пара (кПа): 11,3 (20°С),
26,67 (40°С), 108,7 (80°С);
0,40 мПа*с (20°С), 0,25 мПа*с (60°С); давление пара (кПа): 11,3 (20°С),
26,67 (40°С), 108,7 (80°С);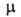 (пар) 1,29-10 29 Кл*м; потенциал ионизации 10,75 эВ; ркрит
3,54 МПа, tкрит 246°С; С°р 2,09
(пар) 1,29-10 29 Кл*м; потенциал ионизации 10,75 эВ; ркрит
3,54 МПа, tкрит 246°С; С°р 2,09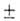 0,12 кДж/(кг*К);
0,12 кДж/(кг*К);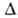 Н°обр-190
кДж/моль (газ), -152 кДж/моль (жидкость). Н°обр-190
кДж/моль (газ), -152 кДж/моль (жидкость).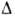 Н°исп
32,6 кДж/моль (0-80 °С); Н°исп
32,6 кДж/моль (0-80 °С);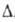 Н°сгор
1,76 МДж/моль, Н°сгор
1,76 МДж/моль,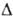 S6
(пар) 274,1 Дж/(моль*К). S6
(пар) 274,1 Дж/(моль*К).
А. смешивается со многими орг. р-рителями; р-римость в воде 7,3% (20°С).
Образует азеотропные смеси с водой (87,5% А.; т. кип. 70,5°С), бензолом
(47% А.; 73,3°С), метанолом (38,7% А.; 61,4°С), ССl4 (21% А.;
66,2°С) и др.
Для А. Наиб. характерны р-ции по связи С=С, в т.ч. полимеризация с образованием
полиакрилонитрила и сополимеризация с бутадиеном, стиролом, винилхлоридом
и др. Для предотвращения самопроизвольной полимеризации А. при хранении
ингибируют NH3, гидрохиноном или др. В присут. оснований А.
легко присоединяет по связи С—С в-ва, имеющие подвижный атом Н (цианэтилирование).
Восстанавливается Н2 над никелем Ренея до пропионитри-ла, в
избытке Н2 -до пропиламина, при электрохим. гидро-димеризации
превращ в адиподинитрил. Хлорируется до 1,2-дихлор- и 1,1,2-трихлорпропионитрила.
Вступает в диеновый синтез, образуя ненасыщ. циклич. нитрилы. Под действием
конц. H2SO4 превращ. в акриламид и акриловую к-ту.
Осн. пром. метод получения А.-окислит. аммонолиз пропилена (кат.-молибдаты
или фосформолибдаты Bi, молибдаты или вольфраматы Те и Се, оксиды Sb, U,
Sn и Fe):
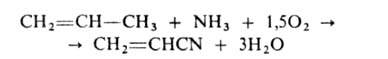
Процесс проводят при 400-485°С и длительности контакта 2—4 с (стационарный
кат.) и 10-20 с (псевдоожиженный кат.). Исходная смесь содержит 5-8% С3Н6,
5-9% NH3, 0-30% водяного пара (остальное-воздух). Наряду с основной,
сильно экзотермичной р-цией (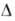 Н
= = -515 кДж/моль), происходит образование HCN, ацетонитрила, СО и
СО2. Реакц. газы промывают горячим р-ром (NH4)2SO4
в H2SO4 для связывания NH3, а затем-водой.
Из водного р-ра ректификацией выделяют А. и побочные товарные продукты-HCN
и CH3CN. Выход А. 75-80% по пропилену. Н
= = -515 кДж/моль), происходит образование HCN, ацетонитрила, СО и
СО2. Реакц. газы промывают горячим р-ром (NH4)2SO4
в H2SO4 для связывания NH3, а затем-водой.
Из водного р-ра ректификацией выделяют А. и побочные товарные продукты-HCN
и CH3CN. Выход А. 75-80% по пропилену.
А. получают также прямым присоединением HCN к ацетилену. Смесь С2Н2
и HCN [мольное соотношение (5-10):1] барботируют через водный р-р, содержащий
CuCl, HC1, КС1 и NaCl, при рН 1-3, 70-90°С и давлении, близком к атмосферному.
А. очищают ректификацией; выход 80-90% по HCN.
А. используют в произ-ве полиакрилонитрильных волокон, АБС-пластиков,
бутадиен-нитрильного каучука, сополимеров с винилхлоридом, стиролом (пластик
САН) и др., цианэтилцеллюлозы, акриламида, метилакрилата, глутаминовой
к-ты и адиподинитрила. Мировое произ-во А. более 2,5 млн. т/год (1980).
А. обладает раздражающим действием, легко всасывается через неповрежденную
кожу; токсич. действие подобно цианидам; ПДК 0,5 мг/м3, в воде
водоемов-2 мг/л. Т. всп. 0°С, т. воспл. 2°С, т. самовоспл. 370°С, КПВ 3-17%,
температурные пределы воспламенения от -5 до 25 °С
Произ-во в СССР 209 тыс. т (1985).
===
Исп. литература для статьи «АКРИЛОНИТРИЛ»: Далин М. А., Колчин И. К., Серебряков Б. Р., Нитрил акриловой
кислоты, Баку, 1968; Бобков С. С., Смирнов С. К.. Синильная кислота, М,
1970; Теддер Дж., Нехватал А., Джубб А., Промышленная органическая химия,
пер. с англ., М., 1977; Kirk-Othmer encyclopedia, 3 ed., v. I, N.Y.-[a.o.],
1978, p. 414-26. C.K. Смирнов.
Страница «АКРИЛОНИТРИЛ» подготовлена по материалам химической энциклопедии.
|

