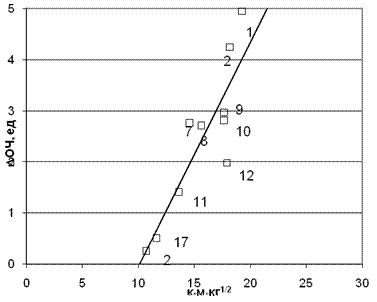
Рис. 6. Корреляция приращение ОЧ от произведения заряда на аминном протоне qH
на время молекулярного контакта при относительном вращении
(Rg1M00,5 Rg1M0,5) (для молекулярной массы M0=34). Коэффициент корреляции 0,887. Точки на графике соответствуют номерам аминов в табл. 1. В этом массиве аминов имеется еще одно примечательное обстоятельство. Этилендиамин при аналогичной корректировке частоты вращения совсем не улучшает корреляцию, поэтому его пришлось оставить без учета бифункциональности его молекулы. Очевидно, мы здесь встречаемся с особым случаем. Из литературы известно, что соединения с двойными связями повышают ОЧ, т.к. способны обрывать цепные процессы и тем самым уменьшать вероятность продолжения и разветвления цепи в предпламенных процессах. Молекула этилендиамина является «ловушкой» для радикалов и перекисей как амин и как носитель π-электронов. В данном случае если симметрия молекулы по аминным группам не проявляет себя, то очевидно такую экзальтацию молекулы амина остается приписать только облаку π-электронов. Более того, можно даже попытаться сделать сравнительную количественную оценку эффективности двойной связи. Действительно, этилендиамин и бутандиамин по своей эффективности попадают в вилку между пара- и орто- ксилидинами. Что касается бутандиамина молекулы только с σ-электронами, то здесь, как мы выяснили, играет роль бифункциональность и симметрия молекулы. Высокую сравнительную эффективность молекулы с облаком π-электронов можно объяснить, если приписать двойной связи эффективный отрицательный электрический заряд равный разности зарядов на атомах азота ксилидинов и этилендиамина(см. табл. 1):
Δq = 0,863 0,538 = 0,325 Весьма вероятно, что здесь мы встречаемся с замечательным явлением синергизма, когда два явления разной природы складываются и дают объединенный эффект. Молекула этилендиамина с одной стороны является «ловушкой» для радикалов и перекисей как амин, с другой наличие двойной связи в молекуле амина само по себе приводит к обрыву цепи. Этим же обстоятельством, наличием сопряженных двойных связей, вероятно, объясняется сравнительно высокая активность ариламинов (анилина и монометиланилина). Для М0=48 (гидроперикись метана) коэффициент корреляции резко понижается и становится равным 0,483. Таким образом, результаты корреляции показывают, что в нее лучше укладывается допущение, что амины улавливают чистую перекись водорода, а не радикалы гидроперикисей. Сравнение корреляций и для этой группы топлив позволяет сделать вывод о том, что и для этого ряда аминов существенными являются водородные связи возникающие между протонами амина и атомами кислорода перекисей. По данным работы [4] был проведен анализ для топлив с ОЧ 91,5 с добавками следующих аминов: анилин, метиламин, этиламин, изопропиламин и n-бутиламин в концентрации 0,1 моль. Для группы аминов, исследованных с этим топливом, также проводился корреляционный анализ для выявления природы промоторов. Варьировалось значения М0 с шагом равным 4 в пределах от 16 до 68 единиц массы и рассчитывалось значение коэффициента корреляции, что и представлено на рис. 7. 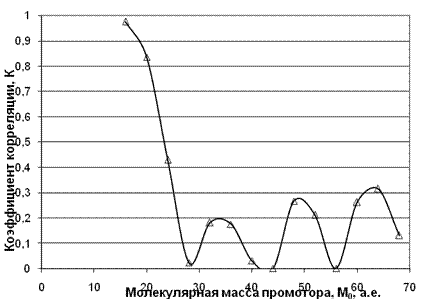
Рис. 7. Зависимость коэффициента корреляции от молекулярной массы промотора. Анализ коэффициента корреляции в его зависимости от молекулярной массы промотора показывает 4 максимума в районе М0=16, 36, 48, 64. Эти данные позволяют утверждать, что вероятнее всего (коэффициент корреляции равен 0,976) мы имеем дело с атомарным кислородом или радикалом гидроксила. С небольшим статистическим весом в предпламенных процессах могут участвовать также и чистая перекись водорода с высшими перекисными радикалами ROOH. И в этом случае корреляция для прироста ОЧ от произведения величины заряда на амином протоне на время молекулярного контакта ( имеет коэффициент корреляции 0,885 и оказывается гораздо лучше, чем с зарядом на атоме азота. Сравнение корреляций и для этой группы топлив позволяет сделать вывод о том, что, и для этого ряда аминов существенными являются водородные связи, возникающие между протонами амина и атомами кислорода перекисей. Полученные корреляции (см. рис. 8) позволяют сделать еще один вывод о том, что корреляция для этой группы аминов значительно лучше, если выбрать значения для М0=17 (это соответствует радикалу ОН) коэффициент корреляции =0,885 для протона амина и 0,951 и 0,714 для атома азота. Если взять М0=34, что соответствует перекиси водорода, то коэффициент корреляции резко падает вплоть до полного отсутствия корреляции к=0,042. 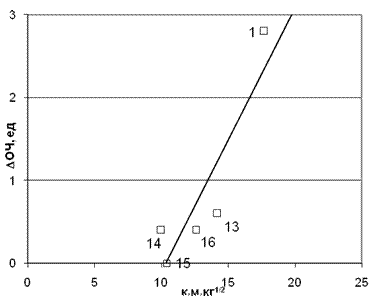
Рис. 8. Корреляция приращения ОЧ от произведения заряда на аминном протоне
на время молекулярного контакта (коэффициент корреляции 0,885 для молекулярной массы M0=34) Точки на графике соответствуют номерам аминов в табл. 1. Возможность реализации такого же механизма действия добавок к топливам была проверена и для вторичных аминов. Все необходимые свойства аминов сведены в табл. 2. [2-4]. По изложенной выше методике для топлив I группы была получена корреляция, где в качестве добавок были применены соответствующие соединения (табл. 2.). Корреляция приращения ОЧ от произведения заряда аминного протона на время контакта показала, что в этом случае коэффициенты корреляции значительно хуже и составляет, для М0=34 всего 0,541. Здесь интересно отметить рокировку N-трет-бутилфурфуриламина и пиперидина. Судя по значению заряда на протоне у первого он значительно ниже, но в структуре его молекулы наблюдается следующая особенность: здесь, на расстоянии примерно равном длине молекулы перекиси водорода, находятся рядом два атома – азота и кислорода в кетонной группе. Этот фрагмент молекулы может связать молекулу перекиси сразу двумя водородными связями: первая возникает между протоном перекиси и кетонным кислородом, а вторая между кислородом перекиси и протоном амина. Следовательно, данный амин является бифункциональным. Амины, приведенные в табл. 2, вводились в топливо в концентрации 0,1 моль. Результаты корреляции проведенной по описанной выше методике показали, что наилучшее значение коэффициента корреляции получается в том случае, если взять перекись водорода с М0=34. Иными словами, и в данной группе амины-«ловушки» связывают охотнее всего перекись водорода. В заключение отметим, что для N,N-(диметил)трет-бутиламина – (11) с его аномально низким зарядом δq=0,046, нам не удалось в рамках предложенного механизма найти объяснение аномально высокой его эффективности. Особенностью структуры молекулы этого соединения является ее разветвленность. В работе [7] на модельных топливах исследовался процесс предпламенного окисления смеси линейного (н-гептан) и разветвленного (изооктан) углеводородов, и было найдено, что разветвленный углеводород в условиях предламенных температур не подвергается окислению, поскольку имеет более высокую энергию активации окислительного крекинга. На прямом опыте было установлено, что добавление изооктана к н-гептану приводит к пропорциональному снижению температуры смеси топлив, что можно рассматривать как разбавление реакционно-способного н-гептана химически инертным в тех же условиях изооктаном. Таким образом, изооктан в данных условиях выполняет роль ингибитора окислительного предпламенного процесса. В работе [9] также обсуждалось различие н-гептана и изооктана, имеющих полярные значения ОЧ. Здесь химическая пассивность компактных разветвленных молекул изооктана связывается с малым значение сечения столкновения по сравнению с этим же параметром для линейных молекул, для которых сечение столкновения, а значит и предэкспонент в константе скорости химической реакции, значительно больше. Отсюда можно сделать вывод, что разветвленные молекулы практически не участвуют в окислительных предпламенных процессах из-за торможения химических процессов, как по причине высоких энергий активации, так и из-за небольшого значения предэкспоненты в константе скорости химической реакции. Возможно обсуждаемый третичный амин работает по такому же механизму. По механизму образования водородных связей он просто работать не может, т.к. в его молекуле отсутствуют подвижные аминные протоны. Скорей всего влияние на ОЧ N,N-(диметил)трет-бутиламина связано с локальным понижением температуры и, вследствие этого, уменьшением начальной концентрации no радикалов – промоторов (см (3)-(5)).
|
