Механизм роста углеводородной цепи до конца не выяснен. В работе Бартоломью показано, что на Co- и Ni- катализаторах СО гидрируется в метан по двум маршрутам, каждый из которых связан с определенными участками на поверхности [13]. А.Л. Лапидус с сотрудниками выдвинули двухцентровую модель Co-катализатора синтеза ФТ [14-19]. Согласно этим представлениям, центрами первого типа являются кристаллиты металлического Со. На них СО адсорбируется диссоциативно и затем гидрируется в метан. На этих же центрах происходит реакция диспропорционирования CO, приводящая к зауглероживанию катализатора. Центры второго типа представляют собой границу между металлическим Со и оксидной фазой на поверхности катализатора. Они ответственны за рост углеводородной цепи. Оксид углерода адсорбируется на Со0 в слабосвязанной ассоциативной форме, затем перемещается на носитель, где образует с водородом поверхностные комплексы типа CHxO. Эти комплексы взаимодействуют друг с другом, образуя полимерные структуры на поверхности. Их гидрирование на Со0 дает углеводороды:
CO + Co - COads/Co; COads/Co - COads/oxide; COads/oxide + H2 - C^Oads/oxide;
CHxOads/oxide + nCO + 2"H2 - CnH2n+1ads/oxide; CnH2n+1ads/oxide - CnH2n+1ads/Co; CnH2n+1ads/Co + H2 - CnH2n+2.
Два типа адсорбции СО на поверхности обнаруживаются по спектру ТПД СО, в котором центрам первого типа отвечает пик с Tmax в области 250-350°С, центрам второго - Tmax < 250°C. По соотношению площадей пиков можно судить о доле каждого из типов центров и, соответственно, предсказывать каталитическое действие контакта. Эксперименты показали хорошую корреляцию между выходом углеводородов и количеством центров слабосвязанной адсорбции СО на поверхности контакта [14, 15].
Оксидная фаза Со-катализаторов обычно формируется в процессе их предварительной термообработки (прокаливания и/или восстановления) вследствие взаимодействия оксидного носителя (SiO2, Al2O3 и др.), оксида кобальта и промотора. Катализаторы, не содержащие оксидной фазы, не способны катализировать образование жидких углеводородов из СО и Н2, поскольку не имеют на своей поверхности центров полимеризации. Например, Со0/С проявляет высокую активность в метанировании СО, однако более тяжелые продукты на нем практически не образуются [20].
Таким образом, оксидная фаза катализаторов синтеза ФТ играет определяющую роль в образовании жидких углеводородов, и для создания эффективных катализаторов этого процесса необходимо особое внимание уделять подбору носителя и проведению предварительной термообработки катализатора. Воздействуя на активную часть катализатора путем предварительной термообработки, приводящей к усилению взаимодействия активной фазы с носителем, или вводя в состав катализатора модифицирующие оксидные добавки, можно усилить полимеризационные свойства катализатора и, следовательно, увеличить селективность реакции в отношении образования жидких углеводородов [14, 15].
Промышленный реактор синтеза ФТ должен обеспечить высокую скорость превращения синтез-газа, изотермичность, эффективный отвод тепла, минимальные потери катализатора. Кроме того, желательно, чтобы реактор был конструктивно прост и надежен в эксплуатации. Наиболее серьезной проблемой, стоящей перед проектировщиками, является необходимость хорошего теплоотвода. Местные перегревы недопустимы, так как приводят к закоксовыванию катализатора, а в случае Со-контактов - еще и к повышенному образованию метана. Конструкция реактора во многом определяется также видом продуктов, для получения которых он предназначен. Не существует универсального типа реактора, подходящего для любого варианта процесса ФТ (рис. 4). 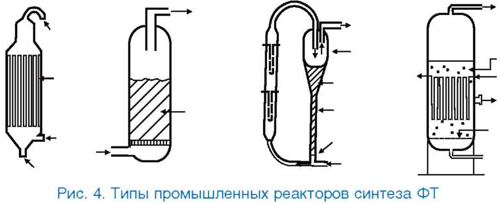
Все многообразие технологий получения углеводородов из СО и Н2 можно свести к двум основным типам процессов ФТ - высокотемпературному (320-360 °С) и низкотемпературному (180-250 °С). Первый реализован на заводах фирм Sasol и Mossgas в ЮАР. Первоначально использовались реакторы с циркулирующим кипящим слоем железного катализатора, аналогичные реакторам каткрекинга. Однако в настоящее время Sasol заменяет их на конструктивно более простые реакторы с фиксированным кипящим слоем [21]. В продуктах синтеза преобладают легкие олефины, содержание высокомолекулярных парафинов минимально. Реакторы с кипящим слоем обеспечивают хороший теплоотвод и изотермическое протекание процесса. Диффузные ограничения в них минимальны за счет высокой линейной скорости газа и использования мелкодисперсного катализатора. Однако такие реакторы сложно вывести на рабочий режим. Проблемой является отделение катализатора от продуктов. Отдельные узлы подвергаются сильной эрозии. Принципиальным ограничением реакторов с кипящим слоем является невозможность получения в них тяжелых парафинов [10, 22].
В низкотемпературном варианте процесса используются кожухо-трубчатые аппараты. Они просты в эксплуатации, не создают проблем с отделением катализатора, могут использоваться для получения продуктов любого состава. Однако такие реакторы имеют целый ряд недостатков: сложность в изготовлении, большая металлоемкость, сложность процедуры перегрузки катализатора, значительный перепад давления по длине, диффузные ограничения на крупных зернах катализатора, худший по сравнению с кипящим слоем теплоотвод [10, 22]. Тем не менее, именно трубчатые реакторы использованы фирмой Shell на заводе ФТ в Бинтулу и строящемся заводе в Катаре [23].
Реактор пузырькового типа (slurry) считается наиболее эффективным для синтеза ФТ [1]. В этом аппарате синтез-газ проходит снизу вверх через слой высококипящего растворителя, в котором суспензирован мелкодисперсный катализатор. Подобно реакторам с кипящим слоем, в пузырьковом реакторе обеспечиваются эффективный массо-обмен и теплоотвод. В то же время в нем возможно получение тяжелых продуктов, как в трубчатом аппарате. Проблема отделения катализатора была решена, и в 1993 г. коммерческий slurry-реактор был пущен в эксплуатацию [24].
Типичный состав продуктов синтеза в разных конструкциях реакторов представлен в таблице. Интересно, что в пузырьковом реакторе образуется большее количество оксигенатов, чем в кожухотрубчатом аппарате с аналогичным катализатором.
Как было сказано выше, в синтезе ФТ образуется широкая углеводородная фракция. Квалифицированное использование продуктов возможно после их разделения на индивидуальные вещества или узкие фракции. При этом схема разделения и последующей переработки зависит от того, по топливному или химическому направлению работает завод. Очевидно, относительно небольшое производство ФТ экономически оправдано только в случае его направленности на химические реагенты. Так, на Новочеркасском заводе синтетических продуктов действовал блок точной ректификации, позволявший получать индивидуальные углеводороды высокой чистоты, в том числе α-олефины с нечетным числом атомов С, недоступные олигоме-ризацией этилена. Тяжелые фракции шли на изготовление церезина специального назначения. Специалисты компании Sasol считают, что получение реагентов и полупродуктов для химической промышленности в настоящее время более выгодно, чем топлив [21]. В то же время технологическая схема заводов Shell направлена в первую очередь на получение высококачественного дизельного топлива. Возможные направления переработки первичных продуктов синтеза ФТ показаны на рис. 5.
Надо отметить, что крупномасштабное производство ФТ позволяет утилизировать даже те продукты, которые образуются в малом относительно алифатических углеводородов количестве. Так, предприятия Sasol поставляют на рынок спирты, альдегиды, кетоны и кислоты, а также фенол, крезолы, аммиак и серу (с установок газификации угля) [1, 21].
Лаборатория каталитических реакций окислов углерода ИОХ им. Н.Д. Зелинского РАН имеет многолетний опыт изучения катализаторов синтеза ФТ, отраженный в многочисленных публикациях, авторских свидетельствах и патентах. На протяжении многих лет лаборатория плодотворно сотрудничала с Новочеркасским заводом синтетических продуктов в области разработки новых Со-катализаторов. Мы располагаем необходимым оборудованием для проведения научных работ в области синтеза ФТ, в том числе парком аналитических приборов и установками для каталитических испытаний при атмосферном и повышенном давлении. 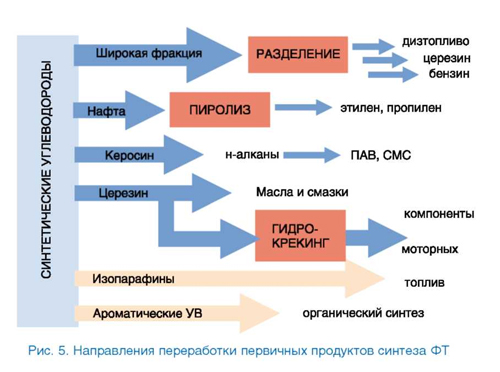
В настоящее время ИОХ РАН работает в сотрудничестве с ООО «ВНИИГАЗ» в рамках договора «Разработка технологии, наработка и испытание опытных партий катализаторов производства синтетических жидких топлив». Глобальной целью этой работы является воссоздание в России собственного производства углеводородов по технологии ФТ на базе природного газа. Основные задачи, решаемые нами на первом этапе работы: • разработка оригинального катализатора синтеза ФТ;
• поиск путей эффективного управления селективностью процесса;
• оптимизация метода приготовления катализатора;
• изучение влияния режима активации катализатора на показатели процесса;
• сбор данных для построения математической модели реактора;
- разработка ТУ и заводского регламента производства катализатора. На следующем этапе предложенный в ИОХ РАН катализатор будет испытан на пилотных установках ООО «ВНИИГАЗ». В заключение подчеркнем, что для России создание собственного производства ФТ выглядит особенно актуальным, поскольку сырьевая база для него (природный газ и уголь) более чем обширна. Список литературы 1. Dry M.E. Applied Catalysis A: General. - 1999. - № 189. - Р. 185.
2. Sie S.T. Stud. Surf. Sci. Catal. - 1994. - № 85. - Р. 627.
3. Dry M.E. Applied Catalysis A: General. - 2004. - № 276, - Р. 1.
4. Davies P. Proceedings of 11th World Clean Air Congress, Durban, South Africa, September 1998.
5. Dry M.E., Horvath (Ed.) I.T. Encyclopedia of Catalysis. - V. 3. -Wiley, New York, 2003. - Р. 347.
6. Rostrup-Nielsen J.R. Catal. Today. - 1994. - № 21. - Р. 257.
7. Dry M.E. Catal. Today. - 1990. - № 6 (3). - Р. 183.
8. Рёпер М. Катализ в С1-химии/ Под ред. В. Кайм. - Л.: Химия, 1987. - С. 57.
9. 9. Li S., Krishnamoorthy S., Li A., Meitzner G., Iglesia E. J. Catal. - 2002. - № 206. - Р. 202.
10. Dry M.E. Applied Catalysis A: General. - 1996. - № 138. - Р. 319.
11. Сторч Г., Голамбик Н., Голамбик Р. Синтез углеводородов из окиси углерода и водорода. - М.: И.Л., 1954. - С. 257.
12. Eilers J., Posthuma S.A., Sie S.T. Catal. Letters. - 1990. - Р. 253.
13. Lee W.H., Bartolomew C.H. J. Catal. - 1989. - № 120. - Р. 256.
14. Лапидус А.Л. Изв. АН СССР. Сер. химия. - 1991. - С. 2681.
15. Лапидус А.Л., Крылова А.Ю. Успехи химии. - 1997. - С. 1032.
16. Rauthousky J., Zukal A., Lapidus A., Krylova A. Appl. Catal. - 1991. -№ 79. - Р. 167.
17. Lapidus A., Krylova A., Rauthousky J., Zukal A., Janchalkova M. Appl. Catal. - 1992. - № 80. - 1.
18. Крылова А.Ю., Лапидус А.Л., Якерсон В.И. и др. Изв. АН. Сер. химия. - 1992. - № 1. - С. 55.
19. А.Ю. Крылова, О.А. Малых, Г.И. Емельянова, А.Л. Лапидус // Кинетика и катализ. - 1989. - № 30(6). - Р. 1495.
20. Steynberg A.P., Espinoza R.L., Jager В., Vosloo A.C. Appl. Catal. A: General. - 1999. - № 186. - Р. 41.
21. Adesina A.A. Applied Catalysis A: General. - 1996. - № 138. -Р. 345. http://www.shell.com/home/Framework?siteId=qatar
22. Jager В., Espinoza R. Catal. Today. - 1995. - № 23. - Р. 17. А.Л. Лапидус (Российский университет нефти и газа им. И.М. Губкина), О.Л. Елисеев (Институт органической химии им. Н.Д. Зелинского РАН) Источник: Газохимия
|
