КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ В ХЛОРОРГАНИЧЕСКОМ СИНТЕЗЕ (II часть)
Процессы окислительного хлорирования
Рассмотрены каталитические процессы окислительного хлорирования предельных и непредельных углеводородов С1-С3, являющиеся основным направлением утилизации хлористого водорода и определяющие сбалансированность по хлору. Проанализированы кинетические и технологические закономерности процессов получения хлорметанов, дихлорэтана и винилхлорида, аллилхлорида. Рассмотрены пути квалифицированной переработки хлорорганических отходов методом гидрирования и оксихлорирования, обеспечивающие полное использование углеводородного сырья.

В предыдущем сообщении [1] нами было указано, что наиболее целесообразным способом квалифицированной переработки хлористого водорода является метод окислительного хлорирования углеводородов - http://newchemistry.ru/letter.php?n_id=1395&cat_id=6
Переработка хлористого водорода методом окислительного хлорирования (оксихлорирования) нашла широкое распространение, прежде всего, в крупнотоннажных процессах, в 70-х – 90-х годах ХХ века.
Оксихлорирование – процесс хлорирования углеводородов, протекающий при участии окисляющих агентов, в качестве которых обычно используют кислород, в частности, кислород воздуха. Источником хлора в данном процессе, как правило, является хлористый водород. В качестве альтернативных хлорирующих агентов могут быть использованы хлор, хлорид аммония или хлориды металлов переменной валентности [2, c.9].
Основной способ проведения оксихлорирования – газофазный процесс с использованием катализаторов на носителях. В качестве катализаторов применяют соединения меди, щелочных, редкоземельных и некоторых других металлов на пористых носителях разного состава и строения.
В зависимости от исходного углеводородного сырья и температуры процессы оксихлорирования могут осуществляться по различным механизмам, обобщенные схемы которых были предложены в НИФХИ им.Л.Я.Карпова [3].
Схема I. Сопряжение реакции окисления хлористого водорода
2HCl + ½ O2 Û Cl2 + H2O (1)
с реакцией заместительного хлорирования предельных углеводородов:
HR1R2H + Cl2 → HR1R2Cl + HCl (2)HR1R2Cl + Cl2 → ClR1R2Cl + HCl (21)Схема II. Сопряжение реакций (1) и (2) схемы I с реакцией дегидрохлорирования предельных хлорпроизводных углеводородов.
HR1R2Cl → R1=R2 + HCl (3)
ClR1R2Cl → R1=R2Сl + HCl (31)Схема III. Реакция присоединительного оксихлорирования непредельных углеводородов.
R1=R2 + 2HCl + ½ O2 → ClR1R2Cl + Н2О (4)Схема IV. Реакция заместительного оксихлорирования непредельных углеводородов.
R1=R2Н + HCl + ½ O2 → R1=R2Cl + Н2О (5)
Учитывая также побочные реакции глубокого окисления до моно- и диоксида углерода, можно сделать вывод о том, что оксихлорирование углеводородов является сложным, многомаршрутным процессом, условия которого должны подбираться в зависимости от поставленной задачи.
Основой для процесса оксихлорирования послужила газофазная реакция окисления хлористого водорода, открытая Диконом в 1868г.
Окисление хлористого водорода до хлора – обратимая реакция, протекающая обычно при температуре около 400 0С. Зависимость константы равновесия от температуры имеет вид [4]:
Величины Kp и степени конверсии HCl и O2 заметно снижаются с повышением температуры процесса. Увеличение избытка кислорода и повышение давления приводит к увеличению степени конверсии HCl и содержания Cl2 в реакционной смеси, но в интервале температур 600-700К, когда скорость процесса достаточно высока, равновесная конверсия HCl не достигает 90%.
При совместном протекании реакций Дикона (1) и хлорирования (2), (21) равновесие реакции сдвигается за счет расходования хлора, вследствие чего может иметь место практически полное превращение HCl. По этой причине все реакции оксихлорирования алканов, алкенов, а также их хлорпроизводных практически необратимы в рабочем интервале температур [5].
Общепринятой является точка зрения, согласно которой в условиях окисления HCl и высокотемпературного оксихлорирования каталитически активные компоненты, как правило, смеси хлоридов меди, щелочных и редкоземельных элементов, находятся на поверхности носителя в состоянии расплава. Появление в процессе хлоридов одновалентной меди, как и введение в систему хлоридов щелочных металлов, приводит к снижению температур плавления эвтектик в используемых катализаторах.
На основе результатов кинетических и адсорбционных исследований была предложена общая схема реакции Дикона в присутствии хлормедных катализаторов [3, 6, 7]:
быстро2CuCl2 →← 2CuCl + Cl2 медленно2CuCl + O2 →← Cu2O2Cl2 быстроCu2O2Cl2 + 4HCl →← 2CuCl2 + Cl2 +2H2O
Этой схеме соответствует следующее кинетическое уравнение:
r = 4 k K [CuCl2]2 PO2 / PCl2 = k1 PO2 / PCl2
где К – константа равновесия термической диссоциации хлорида меди;
k – константа скорости адсорбции кислорода.
Полученные данные были использованы при исследовании закономерностей окислительного хлорирования предельных углеводородов – метана и этана.
Окисление HCl в присутствии метана протекает по кинетическим закономерностям, установленным для процесса Дикона, т.е. независимо от наличия в реакционной смеси хлорметанов. Другой выявленной особенностью явилась общность кинетических закономерностей образования хлорметанов в реакциях оксихлорирования и прямого хлорирования в присутствии системы CuCl2-KCl. Обе реакции характеризуются первым кинетическим порядком по метану, дробным по хлору и практически одинаковыми значениями энергии активации (113 кДж/моль). Скорости оксихлорирования и хлорирования могут быть описаны уравнением степенного вида, где порядок по кислороду меняется от 0 до 0,25 [3, 8, 9].
r = k PCH4 PCl20,6 PO2-n
Окисление HCl идет во всем объеме расплава на катализаторе, в то время как реакции хлорирования метана и хлорметанов, а также их окисление – на поверхности расплава. Кроме того, эти реакции протекают на разных активных центрах, причем присутствие катиона переходных металлов в центрах, на которых идет хлорирование, не обязательно. Реакция хлорирования метана до 425 0С протекает преимущественно по гетерогенному механизму, а при более высоких температурах превалирующим может быть гетерогенно-гомогенный механизм с квадратичным обрывом цепи по хлору.
Технологическое оформление процесса оксихлорирования метана может быть различным, с использованием псевдоожиженного или неподвижного слоя катализатора. Возможна комбинация обоих вариантов, обеспечивающая эффективный теплосъем и высокую степень превращения исходных реагентов.
Определенные перспективы представляют возможность промышленной реализации процесса оксихлорирования этана с непосредственным получением целевого продукта – винилхлорида. Пик исследовательских работ в этом направлении пришелся на 70-е - 80-е годы ХХ века и был сопряжен с существенной дешевизной природного газа в сравнении с аномально высокими ценами нефтяного сырья в этот период.
Как с научной, так и с прикладной точек зрения интерес представляет гетерогеннокаталитический, газофазный процесс оксихлорирования этана. Процесс протекает в присутствии традиционных катализаторов Дикона – хлорида меди с добавками на инертном носителе. В зависимости от условий проведения процесса возможно образование широкой гаммы хлорпроизводных этана и этилена. Для преимущественного образования винилхлорида предпочтительны высокие температуры 400-550 0С.
Как и при оксихлорировании метана, процессы образования хлора и последующего хлорирования протекают на различных активных центрах. Оксихлорирование этана и хлорпроизводных этан-этиленового ряда представляет собой сложный гетерогенно-гомогенный процесс, протекающий через ряд параллельно-последовательных стадий хлорирования, дегидрохлорирования, дехлорирования и сопровождается реакциями глубокого окисления исходных веществ и полупродуктов. Общая схема превращений этана выглядит следующим образом [10]:
гомогенно гомогенно гетерогенно гетерогенно
С2Н6 → С2Н5Сl → 1,1-С2Н4Сl2 → С2Н3Сl → С2Н3Сl3
гомогенно ↓ ↑ гомогенно
С2Н4 → 1,2-С2Н4Сl2гетерогенно
При проведении процесса при температуре 500-550 0С основными продуктами являются винилхлорид и этилен, суммарный выход которых достигает 80% [11]. Скорость убыли этана не зависит от парциального давления HCl и хорошо описывается следующим уравнением [12]:
r C2H6 = k1 PC2H6 PCl20,5Аналогичным закономерностям подчиняется и скорость убыли хлорпроизводных метана за исключением 1,1-дихлорэтана.
В ходе процесса оксихлорирования этана протекают также побочные реакции окисления углеводородов и их хлорзамещенных с образованием оксидов углерода. Скорость реакций окисления описывается уравнением:
Основной вклад в скорость образования продуктов глубокого окисления вносят ненасыщенные соединения [13]; при этом введение одного атома хлора в молекулу резко (в 7-8 раз) увеличивает скорость окисления. Дальнейшее увеличение количества атомов хлора уменьшает выход продуктов СОх: три- и тетрахлорэтены в условиях процесса практически не окисляются. Наилучшие технологические показатели процесса достигнуты при использовании катализаторов CuCl2-KCl/носитель, удельная поверхность которых не должна превышать 10 м2/г. Избирательность процесса по винилхлориду составляет 35-40% при степени превращения этана ~95% [14]. При таких значениях конверсии реагентов и в присутствии водяного пара (один из продуктов процесса) происходит вторичные превращения: восстановление винилхлорида до этилена, а ацетилена до оксида углерода.
Несмотря на глубокую научную и технологическую проработку, процессы оксихлорирования метана и этана в промышленных условиях пока не реализованы.
Причиной этого являются высокие капитальные вложения в сочетании с уменьшившимся спросом на хлорметаны (выпуск четыреххлористого углерода вообще запрещен Монреальским протоколом 1987г.). Прямая переработка этана в винилхлорид сопровождается образованием бóльшего количества отходов по сравнению с «этиленовым» процессом. Определенную роль играет также бóльшая доступность сырья для получения этилена (бензин, дизельное топливо) применительно к европейским странам.
Из процессов окислительного хлорирования наибольшее практическое значение имеет окислительное хлорирование этилена с получением 1,2-дихлорэтана как ключевая стадия сбалансированной схемы производства винилхлорида. Окислительное хлорирование этилена протекает на катализаторах, содержащих CuCl2, при значительно более низких (200-3000С) температурах, чем процессы Дикона или оксихлорирование предельных углеводородов, и не включает стадию окисления HCl. Механизм оксихлорирования включает стадию взаимодействия этилена с CuCl2, в результате которого образуется восстановленная форма меди:
Эта схема подтверждается наличием в катализаторе одно- и двухвалентной формы меди, причем с повышением температуры оксихлорирования содержание Cu+ увеличивается [15, c.78].
Хлорид меди является наиболее эффективным катализатором данного процесса, что подтверждается экспериментальными и расчетными данными, устанавливающими связь между каталитической активностью хлоридов металлов переменной валентности (МСl) с теплотой образования связи М-Сl согласно приведенному механизму. На рис.1 представлены данные для скоростей реакций хлорирования и окисления, подтверждающие преимущества хлорида меди перед другими катализаторами.
Кинетика процесса оксихлорирования этилена изучалась рядом авторов [14,16-22]. В ходе исследований, проведенных в НИФХИ им.Л.Я.Карпова, было показано, что хлористый водород способствует лучшему диспергированию солевой фазы, а скорость процесса в упрощенном виде может быть записана уравнением:
На основании кинетических данных предполагается, что взаимодействие катализатора с этиленом протекает медленно и предшествует стадии реокисления катализатора с участием кислорода. Отсутствие зависимости скорости от парциального давления HCl позволяет предположить, что адсорбция HCl на катализаторе, являющаяся первичным актом процесса, протекает быстро.
Авторами настоящей работы было получено уравнение вида:r = k PC2H4 РО20,5 [23], которое было использовано для расчета промышленного реактора “кипящего” слоя.
Важнейшую роль в протекании процесса играет природа носителя. В отличие от силикагеля, практически инертного по отношению к солевым системам, использование γ-Al2O3 приводит к увеличению акцепторной способности катиона меди за счет образования мостиковых связей между катионами меди и катионами носителя. Это облегчает разрыв двойной связи этилена при его взаимодействии с катионами меди. Хлористый водород участвует не только в увеличении дисперсности солевой фазы на поверхности катализатора, но и в формировании каталитически активных центров на поверхности γ-Al2O3 и в регенерации исходного состояния меди. Роль кислорода сводится не только к окислению Cu+ до Cu2+ , но он также способствует миграции ионов хлора с образованием CuCl2. Схема процесса может быть выражена следующим образом [23].
Cl Cl Cl Cl Cl ClC2H4Cl Cl / / / / Cu Cu Cu Cu (1a) (1в)– Al – O – Al – O – Al – + C2H4 ® – Al – O – Al – O – Al – ® | | | | | | Cl Cl | | Cu Cu (1с)®– Al – O – Al – O – Al – + C2H4Cl2 (1) | | | Cl Cl Cl O Cl | | / / ( I ) Cu Cu Cu Cu (1с) (2а)– Al – O – Al – O – Al – + ½ O2 ® – Al – O – Al – O – Al – (2) | | | | | | Cl O Cl Cl Cl Cl Cl / / / / Cu Cu Cu Cu (2а) (1а)– Al – O – Al – O – Al – + 2HCl ® – Al – O – Al – O – Al – + H2O (3) | | | | | |
Наряду с хлоридом меди в катализаторы оксихлорирования этилена могут вводиться в качестве промоторов или стабилизаторов хлориды таких металлов как лантан, магний, калий и др., которые, с одной стороны, увеличивают способность катионов меди к координационному связыванию с олефинами, с другой стороны, способствуют уменьшению доли побочных реакций, в частности, реакций глубокого окисления [15, c.79].
Побочные продукты в процессе оксихлорирования этилена могут быть условно разделены на две группы:
1. Побочные хлорорганические продукты, которые включают в себя большую часть хлорзамещенных углеводородов С1-С2 как парафинового, так и олефинового ряда;
2. Продукты глубокого окисления – СО и СО2.
Ввиду того, что на долю оксидов углерода приходится до 70% этилена, превращающегося в побочные продукты, исследование условий их образования является важной прикладной задачей. Показано [23], что скорость образования продуктов СОх описывается уравнением типа:
r = kH Pi PO20,5где i - этилен или дихлорэтан, причем скорость окисления дихлорэтана примерно вдвое выше скорости окисления этилена.
Окисление этилена и дихлорэтана протекает, в основном, на активных центрах, содержащих фазы CuCl2 и Cu2(OH)3Cl, избыточных относительно взаимодействия с носителем [24,25]. Принимая активные формы меди в качестве активных центров реакций глубокого окисления, можно полагать, что в схеме (I) реокисленная форма меди по реакции (2), координационно связанная с носителем, окисляет органический субстрат. Реакция окисления конкурирует с реакцией (1) приведенной схемы, что объясняет тормозящую роль HCl в реакциях окисления.
Общая схема образования оксидов углерода в процессе выглядит следующим образом
Соотношение скоростей маршрутов образования продуктов СОх r1 : r2 : r3 =1:2:0,3
Данные, полученные при исследовании структуры катализаторов и ее влияния на кинетические и технологические параметры, были использованы при разработке промышленного процесса оксихлорирования этилена.
Все процессы оксихлорирования этилена могут быть разделены по двум основным признакам: использованию кислорода воздуха или чистого кислорода и применению кипящего или неподвижного слоя катализатора. В таблице 1 приведены характеристики наиболее важных промышленных процессов оксихлорирования.
Таблица 1. Характеристики промышленных процессов оксихлорирования.
Компания | Источник кислорода | Слой катализатора |
| Dow Chem (США) | Воздух | Неподвижный |
| Oxy Vinyls (США) | Воздух, кислород | Кипящий |
| Vinnolit (Германия) | Кислород | Кипящий |
| PPG (США) | Кислород | Кипящий |
| Stauffer (США) | Воздух, кислород | Неподвижный |
| Mitsui (Япония) | Кислород | Кипящий |
| АО «Каустик» (Стерлитамак, Россия) (по технологии НИИ «Синтез») | Кислород | Кипящий |
Во всех промышленных процессах оксихлорирования этилена используют катализатор Дикона, активным компонентом которого является CuCl2 на различных носителях, преимущественно, на оксиде алюминия вследствие его более высокой эффективности, прочности на истирание, возможности регулировать его удельную поверхность. Катализатор кипящего слоя готовят на микросферах диаметром 20-100 мкм, средний радиус пор составляет 40-60 нм. Катализаторы, работающие в неподвижном слое, обычно формуют в цилиндры или шарики диаметром 3-6 мм.
В промышленных условиях конверсия HCl практически полная, а селективность образования 1,2-дихлорэтана достаточно высока как в кипящем, так и в неподвижном слое катализатора. Выход 1,2-дихлорэтана по этилену и хлористому водороду превышает 98%.
Поскольку реакция оксихлорирования этилена весьма экзотермична (238 кДж/моль), из реакторов необходимо отводить большое количество тепла. В реакторах с кипящим слоем катализатора отвод тепла осуществляют с помощью охлаждающих змеевиков, погруженных в кипящий слой. Температура процесса составляет обычно 210-2400С. Так как кипящий слой практически изотермичен, то условия процесса одинаковы по всему слою. Оптимальная температура процесса достигается, прежде всего, за счет изменения режима работы охлаждающих элементов. По этой причине активность катализатора мало влияет на поддержание температуры. Выбор катализатора основан главным образом на его стойкости к истиранию, способности к ожижению слоя и селективности. Катализаторы, работающие в кипящем слое, должны иметь прочную структуру, чтобы исключить возможность образования мелких частиц. Необходимо избегать слипания частиц катализатора, которое может нарушить режим кипящего слоя или даже полностью исключить его образование [26].
Агломерация частиц характерна для катализаторов, содержащих избыточные относительно взаимодействия с носителями фазы хлорида и гидроксохлорида меди. В режиме с преимущественным содержанием хлористого водорода в катализаторе происходит разрушение алюминатов одновалентной меди с образованием CuCl, нарушением баланса CuCl-CuCl2 и формированием нестехиометрического комплекса HCuCl2•0,5H2O с низкой температурой плавления (145 0С) [24,27].
Нами показано [23], что оптимальным является катализатор с максимальным атомным соотношением Al:Cu на внешней поверхности зерна. В этом случае на поверхности находится не более 25% всей меди, содержащейся в катализаторе. Именно это определяет возможность работы с малым (не более 2%) избытком этилена к хлористому водороду, а также низкую селективность процессов окисления, протекающих преимущественно на избыточных медьсодержащих структурах.
Процесс оксихлорирования этилена может быть также осуществлен в неподвижном слое катализатора. Технология этого процесса и процесса в псевдоожиженном слое существенно различаются. Ввиду сильной экзотермичности реакции оксихлорирования и возможности локальных перегревов, реакторный узел состоит обычно из трех последовательно соединенных реакторов. Воздух подается в каждый из реакторов; этилен и хлористый водород в полном объеме поступают в первый реактор. Конверсия хлористого водорода на выходе из последней секции приближается к 99%.
Процесс протекает при температуре 220-280 0С. По этой причине требования к катализаторам, используемым в каждом из трех реакторов, могут быть различными. В качестве носителя обычно используют оксид алюминия с удельной поверхностью 200-400 м2/г. Активными компонентами являются хлориды меди и калия. Увеличение содержания меди в катализаторе способствует повышению его активности. Например, в процессе фирмы «Stauffer» используют три катализатора: А, Б, В, концентрации хлоридов меди и калия в которых представлены ниже.
Катализатор | А | Б | В |
| CuCl2 ,% мас. | 6,0 | 10, | 18,0 |
| KCl, % мас. | 3,0 | 3,0 | 1,8 |
Активность катализаторов увеличивается от первого реактора к третьему [26]. Типичные варианты технологических схем процессов оксихлорирования этилена в псевдоожиженном и неподвижном слое катализатора представлены на рис.2 и 3.
Процесс оксихлорирования этилена с неподвижным слоем катализатора несколько более селективен по сравнению с псевдоожиженным слоем, однако, более сложен в эксплуатации и менее технологичен. Поэтому выбор метода оксихлорирования определяется часто субъективными обстоятельствами. По состоянии на 2003г. порядка 70% всех известных промышленных процессов осуществлены в псевдоожиженном слое катализатора.
Окислительное хлорирование пропилена представляет промышленный интерес с точки зрения непосредственного получения аллилхлорида одностадийным замещением водорода на хлор. При использовании традиционных катализаторов, например, CuCl2-MgCl2 – LiCl/ пемза необходимы высокие температуры (450-5000С). селективность образования аллилхлорида достигает 90%, активность катализатора составляет 2,33.10-3 моль/(кг.с) [28]. Металлы платиновой группы более активны в этом процессе: температура может быть снижена до 240-260 0С [29]. Предполагается, что аллилхлорид образуется в присутствии палладия через стадию p-аллильного комплекса; палладий при этом хлорируется: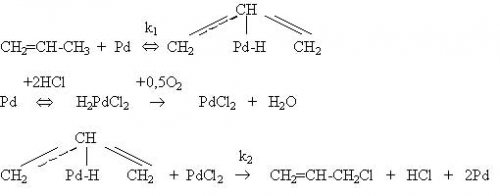
Скорость образования аллилхлорида можно представить уравнением:
r = k2 K1[PdCl2][Pd] PC3H6
Катализаторы также играют важную роль в реализации принципа сбалансированности процессов по углеводородному сырью. Наиболее перспективным является создание промышленных процессов оксихлорирования хлоруглеводородов С2 - С3 с получением три- и перхлорэтилена, а также их селективного гидрирования с получением соответственно этилена и пропилена и возвратом их в технологический цикл.
Оксихлорирование хлорпроизводных С2 - С3 проводят в присутствии смеси хлоридов меди и калия, нанесенных на пористый носитель. Предпочтительно использование носителей с низкой удельной поверхностью (10-15 м2/г) с целью снижения образования побочных продуктов глубокого окисления [30,31]. Установлено, что при температурах, превышающих 350 0С, на медьсодержащих носителях протекает реакция окисления хлористого водорода до хлора и участие последнего в дальнейших превращениях. Скорость оксихлорирования 1,2-дихлорэтана описывается уравнением (аналогичным принятому для оксихлорирования алкенов [32]):
![]()
:
При 380-4000С выход три- и перхлорэтилена достигает 70%, а при организации рецикла промежуточных продуктов может достичь 85-90%. Выход продуктов горения не превышает 10% [33]. Увеличение избытка хлорирующего агента (смеси HCl + O2) ведет к повышению селективности образования целевых продуктов.
Технология данного процесса разработана во ФГУП НИИ «Синтез» с КБ и предложена для реализации в промышленных условиях.
Реакции селективного гидрирования направлены на получение хлоралифитических соединений с пониженным содержанием хлора по сравнению с исходным хлоруглеводородом. Например, при гидрировании хлорпроизводных С2 целевым продуктом является этилен, который вместе с хлористым водородом может быть переработан на стадии окислительного хлорирования.
Тем самым достигается сбалансированность процессов по углеводородному сырью.
Метод гидрирования может быть также использован при переработке четыреххлористого углерода, выпуск которого запрещен Монреальским протоколом 1987г., в хлороформ: CCl4 + Н2 ® CHCl3 + HCl
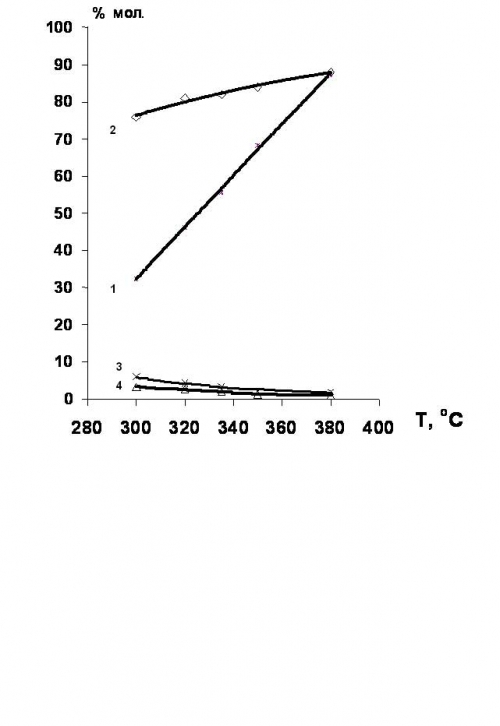
Установлено [34,35], что гидродехлорирование хлорпроизводных этан-этиленового ряда целесообразно проводить в присутствии никельсодержащих катализаторов. Выход этилена в этом случае достигает 80% (рис.4).
Палладиевые катализаторы более активны, но менее селективны по сравнению с никелевыми: основным продуктом в этом случае является этан, выход которого достигает 70%, а выход этилена не превышает 10-15%.
Как нами показано [34], гидродехлорирование идет преимущественно по механизму, предполагающему мультиплетный отрыв атомов хлора от молекулы исходного соединения. Скорость реакции гидродехлорирования выражается следующим уравнением:
Реакционная способность хлоролефинов при этом ниже по сравнению с хлоралканами [35].
В промышленных условиях процесс следует проводить в стационарном слое катализатора с использованием трубчатого реактора. Температура 320-370 0С, время контакта 5-10 с, мольное соотношение водорода на один атом хлора равно 0,5:1.
Катализатор, разработанный для данного процесса, отличается высокой стабильностью.
Для переработки вторичных отходов, таких как гексахлорбензол, гексахлорэтан и др. целесообразно использовать палладиевые катализаторы. Обесхлоренные органические продукты направляются далее на сжигание, а хлористый водород может быть утилизирован в технологическом процессе.
Заключение.
Промышленное значение процессов хлорорганического синтеза в перспективе будет возрастать. Это связано с необходимостью все более широкого, комплексного использования минерального и органического сырья, к которым, в данном случае, относятся поваренная соль и продукты вторичной переработки нефти и природного газа. Необходимым условием этого является минимальное воздействие на окружающую среду. Реализация этого принципа должна осуществляться, по крайней мере, в двух направлениях:
1. Создание процессов, полностью сбалансированных по хлору и углеводородному сырью;
2. Наличие квалифицированной, экологически безопасной технологии переработки отходов производства и потребления хлорорганических продуктов.
Значительная роль в решении этих проблем принадлежит катализаторам. Хотя промышленность хлорорганического синтеза достаточно консервативна, именно использование катализаторов нового поколения позволило в 90-х – начале 2000-х годов достичь степени полезного использования исходного сырья, приближающейся к 100%.
Ситуация в России в этой области далека от оптимальной. Это связано как с отсутствием достаточного количества мощностей по производству хлорорганических продуктов, так и с необходимостью технологической модернизации производств, в частности, по переработке промышленных отходов. Эти проблемы могут быть решены только при условии привлечения крупномасштабных инвестиций.
Сказанное в полной мере относится и к катализаторам, до 70% которых закупаются российской промышленностью по импорту. По-прежнему сохраняется диспропорция между уровнем научных исследований и реализацией результатов этих исследований в промышленных масштабах.
Обнадеживающим моментом явился ввод в эксплуатацию в 1997г. производства винилхлорида по сбалансированной схеме в Стерлитамакском ЗАО «Каустик», впервые созданного по отечественной технологии. В настоящее время и другие российские промышленные предприятия, специализирующиеся на выпуске хлорорганических продуктов, начинают реализовывать планы реконструкции, в основе которых лежат научные и научно-прикладные разработки, о которых шла речь в настоящей статье.
ЛИТЕРАТУРА
1. Флид М.Р., Трегер Ю.А. // Катализ в промышленности, 2003, сообщение 1.
2. Трегер Ю.А., Гужновская Т.Д. Интенсификация хлорорганических производств. Высокоэффективные каталитические системы. М.: Химия, 1984.
3. Гельбштейн А.И. // Всесоюзная школа по катализаторам: Лекции. Новосибирск, 1981. №3. С.33-81.
4. Arnold C.W., Kobe K. // Chem. Eng. Progr., 1952. V.48, № 6. Р.293.
5. Трегер Ю.А., Розанов В.Н., Флид М.Р., Карташов Л.М.// Успехи химии, 1988. Т.LVII, вып.4. С.577.
6. Ruthven D., Kenney C. // Chem. Eng. Sci, 1967. V.22, № 12. Р.1561.
7. Курляндская И.И., Бакши Ю.М., Кудрявцева Т.Ф. и др. // Кинетика и катализ, 1984. Т.25, №3. С.598.
8. Аглулин А.Г. Кинетические закономерности и некоторые вопросы механизма реакции окислительного хлорирования метана на трегерных медьсодержащих солевых катализаторах: Дис…. канд.хим.наук. М.: НИФХИ им.Л.Я.Карпова, 1979.
9. Аглулин А.Г., Бакши Ю.М., Гельбштейн А.И. // Кинетика и катализ, 1976. Т.17, №3. С.670; Бакши Ю.М., Аглулин А.Г., Дмитриева М.П., Гельбштейн А.И. // Там же, 1977. Т.18, № 6. С.1972.
10. Гельперин Е.И., Аветисов А.К., Гельбштейн А.И. // В сб. «Хлористый водород в хлорорганическом синтезе». М.: НИИТЭХим, 1987. С.39.
11. Flid M.R., Kurlyandskaya I.I., Treger Yu.A., Guzhnovskaya T.D. // Studies in Surface Science and Catalysis. 3rd World Congr. on Oxidation Catalysis: San Diego, USA, 1997. V.110. P.305.
12. Гельперин Е.И., Бакши Ю.М., Аветисов А.К., Гельбштейн А.И. // Кинетика и катализ, 1984. Т.25, № 4. С.843.
13. Аветисов А.К., Гельперин Е.И., Гельбштейн А.И. // Там же. С.850.
14. Гужновская Т.Д., Трегер Ю.А., Сонин Э.В., Феофанова Н.М. // В сб. «Хлористый водород в хлорорганическом синтезе». М.: НИИТЭХим, 1987. С.58
15. Трегер Ю.А., Карташов Л.М., Кришталь Н.Ф.// Основные хлорорганические растворители. М.: Химия, 1984. С.83.
16. Carrubba R.V., Spenseк J.L. // Ind and Eng. Chem. Proc. Design and Develop, 1970. V.9, № 9. Р.414.
17. Жерносек В.М., Васильева И.Б., Аветисов А.К., ., Гельбштейн А.И. // Кинетика и катализ, 1971. Т.12, вып.2. С.407; Там же, 1973. Т.14, вып.3. С.795.
18. Сорокин Ю.М., Бакши Ю.М., Гельбштейн А.И. // Там же, 1976. Т.17, вып.4. С.1023.
19. Дмитриева М.П., Бакши Ю.М., Гельбштейн А.И. // Там же, 1985. Т.26, вып.6. С.1359.
20. Мiauchi K., Sato G., Higychi K. еt al.// J. Chem. Soc. Jap. Ind. Chem. Sec. 1968. V.71, №5. Р.695.
21. Wachi S, Asai J. // Ind. Chem. Res. 1994. V.33. P.259.
22. Гельперин Е.И., Бакши Ю.М., Зыскин А.Г. и др. // Химическая промышленность, 1996. №6. С.356.
23. Флид М.Р. Ресурсосберегающие, сбалансированные по хлору технологии получения винилхлорида из этан-этиленового сырья.: Дис. … докт. техн. наук. М., 2003.
24. Флид М.Р., Курляндская И.И., Соломоник И.Г., Баботина М.В.// Химическая промышленность, 1996. №6. С.364.
25. Flid M.R., Kurlyandskaya I.I., Dmitriev Yu.K., Babotina M.V. // Principles and Methods for Accelerated Catalyst Design and Testing. Kluwer Academic Publishers, Netherlands, 2002. P.389.
26. Наворски Дж., Велез Э. // Оксихлорирование этилена: В сб. Катализ в промышленности / Под ред. Б.Лича, М.: Мир, 1986. С.253.
27. Соломоник И.Г. Формирование и поверхностные свойства медьсодержащих солевых катализаторов окислительного хлорирования углеводородов: Дис. … канд.хим.наук. М.: 1992.
28. Канаев Г.И., Потапов А.М., Рафиков С.Р. // Нефтехимия, 1972. Т.12, № 2. С.274.
29. Fujimoto K., Takashima H., Kunugi T. // J. Catal. 1976. V.43, № 1-3. Р.234.
30. Arcoya A., Cortes A., Scoane X.L. // Ind. Eng. Chem. Prod. Res. Develop, 1980. V.19, № 1. Р.82.
31. Карташов Л.М., Кофтюк В.А., Прохорова И.Н., Трегер Ю.А. // Журн. прикл. химии, 1982. Т.55, № 11. С.2493.
32. Карташов Л.М., Трегер Ю.А., Алексеева И.Н. // Современное состояние и перспективы развития теоретических основ производства хлорорганических продуктов: Тез.докл.III Всесоюзн.конф. Баку, 1981. С.33.
33. Атасов А.А., Карташов Л.М., Муганлинский Ф.Ф. и др. // Азерб.хим.журн. 1976. № 3. С.64.
34. Дасаева Г.С., Флид М.Р. Карташов Л.М. и др. // Химическая промышленность, 2000. № 3. С.49; Там же, 2000. № 4. С.43.
35. Дасаева Г.С., Флид М.Р. Карташов Л.М, Трегер Ю.А.// Катализ в промышленности. 2002. № 5. С.24.
Авторы: М.Р. Флид, Ю.А. Трегер, ФГУП «Научно-исследовательский институт «Синтез» с КБ», г. Москва
Рис.1. Зависимость lg константы скорости реакции от величины Н связи M-Cl.
_____ экспериментальные данные
------- расчетные данные
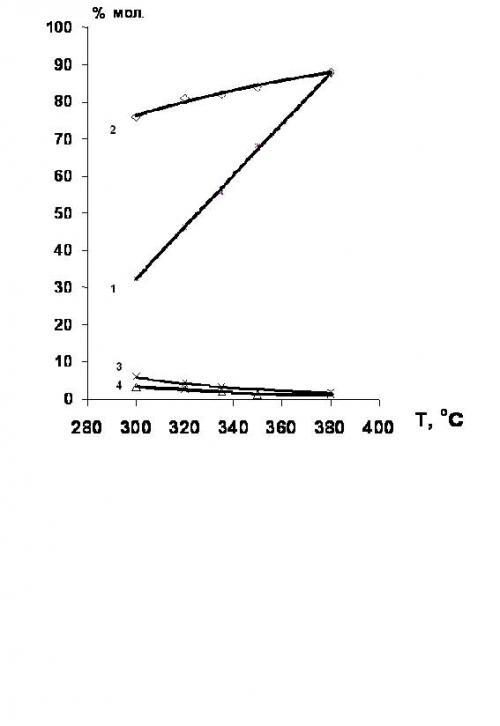
Рис.2. Технологическая схема процесса оксихлорирования этилена в псевдоожиженном слое катализатора
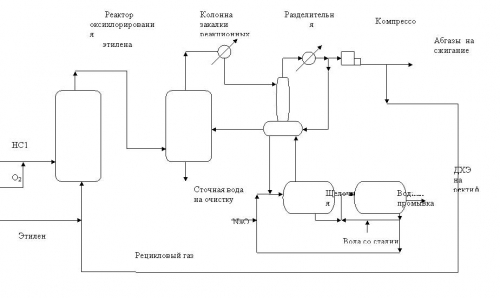
Рис.3. Технологическая схема процесса оксихлорирования этилена в неподвижном слое катализатора.
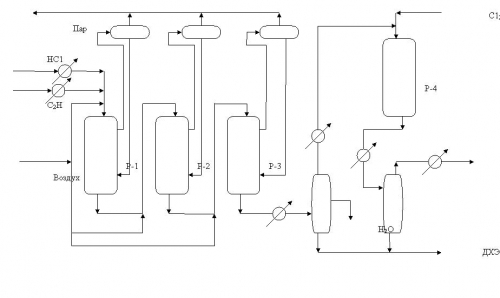
Рис.4. Температурные зависимости конверсии 1,2-дихлорэтана и селективности образования продуктов гидрохлорирования в присутствии Ni-содержащих катализаторов.
1 – конверсия 1,2-дихлорэтана;
селективности образования: 2 – этилена; 3 – этана; 4- этилхлорида