Биомакромолекула и наночастица (часть II)
Сродство катионных наночастиц и ДНК делает возможными осуществлять большое количество биологических применений. Например, защита ДНК от ферментативного расщепления была осуществлена за счет создания комплекса с катионными наночастицами. Сэндху и коллеги использовали серию катионных наночастиц на основе MMPC (1) с различными зонами действия положительного заряда и различной длиной нефункционализированных алкантиолов для доставки плазмидной ДНК, которая способна к независимой репликации. Комплексы ДНК с наночастицами с общим положительным зарядом необходимы для эффективной трансфекции, предположительно с использованием процесса эндоцитоза с помощью заряда, при котором катионные комплексы адсорбируются на мембранах анионных клеток за счет электростатических взаимодействий с последующим поглощением клеткой. Основным определяющим фактором повышения эффективности оказалось максимальное повышение гидрофобности без выпадения в осадок. Томас и Клибанов поместили полиэтиленимин (PEI2) на поверхность наночастиц золота (рис. 8), и исследовали эффективность их функционирования в качестве средств доставки генов. Эффективность трансфекции варьируется в зависимости от молярного отношения PEI:Au в полученном при соединении комплексе, наилучшее соединение в 12 раз мощнее, чем немодифицированный поликатион (рис. 8). Эффективность трансфекции MPC (5) может быть значительно повышена за счет образования комплекса с додецил-PEI2, что подтверждает тот факт, что клеточное поглощение облегчается при повышении гидрофобности агента трансфекции.
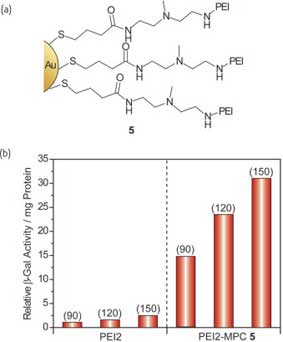
Рис. 8. (a) MPC (5) с разветвленным полиэтиленэмином PEI2. (b) Введение PEI2 в наночастицы увеличивает эффективность трансфекции. Значения, данные в скобках, показывают отношение азота PEI к фосфату ДНК. β-Gal – β- галактозидаза.
Чтобы инициировать взаимодействие ДНК с ММРС, можно использовать и другие способы связывания. Вэнг и сотрудники получили соединение молекул ДНК и наночастиц золота, в состав покрывающего монослоя которых входят группы бромид этидия (3,8-диамино-6-этил-5-фенилфенантридиумбромид) (рис. 9). Каждая наночастица содержит только от одного до двух лигандов тиолата этидия, после связывания наночастиц возникает повышение флуоресценции бромида этидия. Связывание наночастицы (6), функционализированной катионным триметиламмонием (TMA) с молекулой ДНК осуществляется быстро и эффективно благодаря совместному действию внедрения и электростатики. Тем не менее, связывание MMPC (7), функционализированного карбоксилатом, не происходит до тех пор, пока концентрация избыточного NaCl не превысит 0,1 моль/л3. Более слабое сродство тиопронин-этидиевых ММРС возникает из-за конкурирующего образования соединения бромида этидия с ДНК и с анионным тиопрониновым слоем, в результате чего сродство для анионных частиц уменьшается примерно в 10 раз.
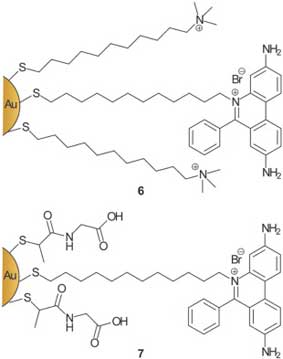
Рис. 9. Наночастицы золота с внедренным этидием для внедрения в ДНК.
Взаимодействие наночастиц с белками.
Наночастицы обладают потенциалом регулирования клеточных процессов, таких как: взаимодействия белок-белок, белок-нуклкеиновая кислота, и ферментативной активности. В качестве примера Фишер и сотрудники разработали кластеры MMPC с анионными функциями для поверхностного распознавания и угнетения активности α-химотрипсина (ChT). Активный центр ChT окружен катионными остатками (рис. 3. часть I), создавая, тем самым, цель для комплементарного электростатического взаимодействия с отрицательно заряженными рецепторами. MMPC (8) взаимодействуют с ChT в ходе двухступенчатого процесса быстрого обратимого соединения, за которым следует более медленный и необратимый процесс денатурирования (рис. 10). Высокоэффективное, комплементарное, электростатическое взаимодействие между ChT и MMPC (8) дает очевидную константу угнетения 10,4 ± 1,3 нM со стехиометрией связывания пяти молекул ChT с одним MMPC.
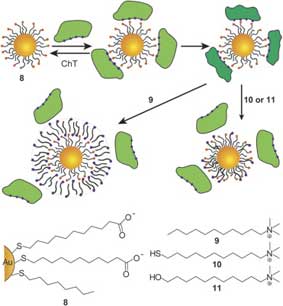
Рис. 10. Образование комплекса ChT с MMPC (8) и механизм его высвобождения с поверхности MMPC за счет добавления различных поверхностно-активных веществ.
Взаимодействие между ChT и MMPC обратимо с использованием катионных поверхностно-активных веществ (Рис. 10). Высвобождение молекул ChT с поверхности MMPC вместе с восстановлением действия ChT был показан с использованием динамического рассеяния света и образцов ферментной деятельности. Было объяснено функционирование двух механизмов высвобождения в зависимости от используемых поверхностно-активных веществ. Алкиловый сурфактант (9) высвобождает связанные белки с помощью образования двухслойных структур, как показывает увеличение гидродинамического радиуса на примерно 4,5 нм. Тем не менее, если используются катионный тиол (10) и спирт (11), выпуск белка можно отнести на счет внедрения поверхностно-активного вещества в монослой наночастицы, поскольку не наблюдается никакого увеличения гидродинамического радиуса наночастицы.
В результате взаимодействия ChT с MMPC (6) происходит денатурирование белка. Искусственно создаваемому денатурированию белка можно найти целый ряд важных применений в терапии. Не так давно Мукхопадхиа со своим коллективом показал, как функционализированные наночастицы золота могут связываться с факторами роста, связывающими гепарин, такими как VEGF165 и bFGF, и угнетать размножение клеток in vitro. Такие уникальные антиангиогенные свойства наночастиц золота указывают на наличие у них потенциала для лечения раковых заболеваний. С другой стороны, для многих практических применений, таких как доставка белка in vivo и стабилизация ферментов in vitro, требуется сохранение собственной структуры белка после связывания. В этой связи, были созданы MMPC (12) и (13) с тетра(этиленгликолевыми) разделителями для повышения стабильности интерфейса ChT и наночастицы на основе использования устойчивости OEG по отношению к неспецифическим взаимодействиям с биомакромолекулами (рис. 11). Исследования флуоресценции и кругового дихроизма (CD) показали, что структура ChT, связанного с MMPC (13) остается в полной неприкосновенности, и, в целом, наблюдается полная реактивация с увеличением концентрации соли, что показывает, что и активность, и структуру протеинов можно довольно удобно регулировать с помощью наночастиц с защитным монослоем. Дальнейшее исследование показало, что образование комплексов наночастицы с протеином может существенно стабилизировать связанные белки по отношению к денатурированию в рамках интерфейса воздух-вода.
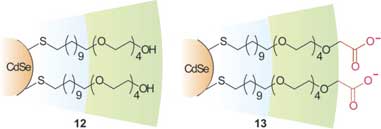
Рис. 11. Многофункциональные наночастицы биоинертные (12) и с селективным связыванием (13).
Ротелло и его коллеги систематически исследовали взаимодействие ChT с серией наночастиц золота, функционализированных аминокислотами (14 на рис. 12). Исследование связывания показывает, что и электростатические, и гидрофобные взаимодействия между гидрофобными полосками рецепторов и протеином, влияют на стабильность комплекса. Микроскопические константы связывания для таких комплексов рецептор-белок составляют примерно 10-10 M−1 (сопоставимо с происходящими естественным путем взаимодействиями ChT-белок), они увеличиваются в зависимости от гидрофобности боковых цепей аминокислот (рис. 12). Скорость денатурирования ChT с MMPC также соотносится с гидрофобностью боковых цепей, при этом гидрофобные аминокислоты оказывают незначительное воздействие на природную структуру связанного ChT, в то время как гидрофильные головные группы дестабилизируют белок. Кроме того, уменьшение длины соединений OEG вызывает более значительное денатурирование связанных протеинов по мере того, как возникают неспецифические взаимодействия.
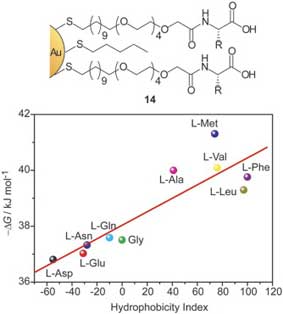
Рис. 12. Структура MMPC с головными группами аминокислот и соотношением между изменениями свободной энергии Гиббса и индексом гидрофобности боковых цепей аминокислот для образования комплекса ChT с MMPC (14).
Интерфейс MMPC-белок дает возможность регулирования ферментативной деятельности за рамками простого угнетения. Ротелло и др. исследовали ферментативную деятельность ChT, связанного с MMPC, по отношению к субстратам с различными зарядами. Электростатическое отталкивание между анионным субстратом и отрицательно заряженным монослоем (рис. 13а) препятствует их доступности активной полости энзима. В противоположность этому, электростатическое притяжение между катионным субстратом и монослоем обеспечивает возможность их транспортировки к активному участку. В результате, ChT, связанный с ММРС, проявляет сильное угнетение по отношению к анионному субстрату (15) и никакого угнетения по отношению к катионному субстрату (17) (рис. 13b). Для нейтрального субстрата (16), наблюдается умеренное угнетение, как результат наличия ограничения транспортировки к/от активного участка.
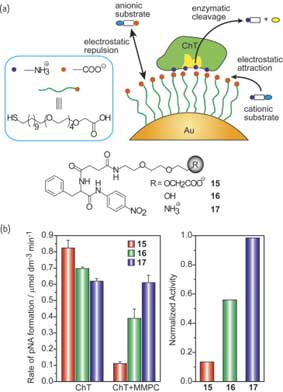
Рис. 13. (a) Химическая структура различных субстратов для ChT и схематическое изображение селективности субстрата, управляемого монослоем. (b) Активность ChT по отношению к различным субстратам (слева) и нормализованная активность ChT, связанного с MMPC, по отношению к субстратам 15-17 (справа).
Для создания протеиноспецифических наночастиц использовались особые биомолекулярные взаимодействия. К числу таких частиц относятся, среди прочих, система стрептавидин/биотин, которая представляет особый интерес, поскольку обладает самым мощным из известных нековалентным биологическим взаимодействием (KS 10 M−1). Зенг и Хуанг привнесли функциональность биотина на поверхность наночастиц золота, которые защищены три(этиленгликолевыми) тиолами. Результаты электрофореза в геле показали, что ММРС особо связывается со стрептавидином для создания стабильных комплексов. Совсем недавно функционализированные биотином квантовые точки были использованы при иммунофлуоресцентном анализе с временным разрешением, где они используются в качестве эффективных поглотителей энергии.
По сравнению со сродством биотина и стрептавидина прочность взаимодействия карбогидрата и белка относительно невелика. Тем не менее, внедрение углеводов в наночастицы может усилить эти взаимодействия за счет многовалентных взаимодействий. Лин и др. подготовили серию наночастиц золота с инкапсулированным карбогидратом, и исследовали их взаимодействие с конканавалином A (Con A), растительным лектином. Они обнаружили, что функционализированные маннозой наночастицы золота продемонстрировали высокую степень сродства с Con A с константами связывания 107–108 л3/моль, а это сродство в 10-100 большее, чем демонстрируемое моновалентными лигандами маннозы. Интересно также отметить, что на силу взаимодействия оказывает влияние размер наночастиц и связующего агента, поскольку именно эти два фактора определяют способность углеводных лигандов связываться совместно с молекулой Con A. Недавно такое специфическое взаимодействие между модифицированной с помощью маннозы наночастицей золота и Con A использовалось для разработки конкурентоспособного колориметрического образца для обнаружения взаимодействий белок-белок. Не так давно для исследования лектина и спермы с помощью флюорометрии были использованы квантовые точки, соединенные с β-N- ацетилглюкозамином. Наночастицы золота, соединенные с лактозой, были сконструированы для целевого воздействия на альбумин, бивалентный лектин со β-d-галактозной специфичностью. Присутствие агглютинирующего вещества вызывает скопление наночастиц золота, функционализированных лактозой, что приводит к ясно различимым изменениям спектра поглощения.
Комплексы металлов с переходной валентностью использовались для целевого воздействия на открытую поверхность гистидинов белка за счет координационных взаимодействий, и соединение комплексов металлов с переходной валентностью с наночастицами дает возможность создавать протеинспецифические рецепторы. В своем интересном исследовании Ху и др. рассказали о создании FePt магнитных наночастиц (18) с Ni-нитрилотриацетной кислотой (NTA). Такие наночастицы могут разделять, транспортировать и закреплять рекомбинантные белки, которые производятся с шестью последовательными остатками гистидина (рис. 14). За счет образования хелата эти наночастицы демонстрируют высокую степень сродства с помеченными гистидином белками, у них высокая способность связывания протеинов благодаря, тому что у них высокое значение отношения площади поверхности к объему. За счет использования данных магнитных частицы, чистые частицы были непосредственно изолированы от смесей растворенных клеток с помощью магнитного разделения в течение 10 минут (рис. 14b). Используя ту же концепцию, исследователи зафиксировали комплекс Ni-NTA на оболочке из оксида железа кобальтовых наночастиц, используя допамин в качестве фиксирующего элемента (MMPC 19). У таких наночастиц высокая специфичность по отношению к помеченным гистидином белкам и исключительная устойчивость к нагреванию и высоким концентрациям солей.
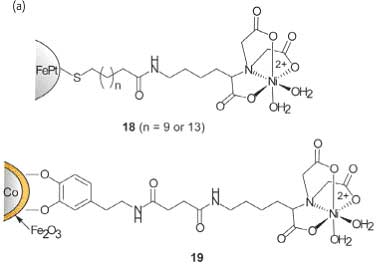
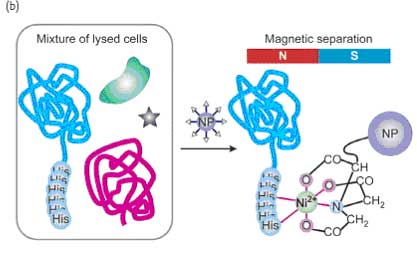
Рис. 14. (a) Структура модифицированных NTA магнитных наночастиц. (b) Поверхностно модифицированные магнитные наночастицы селективно связываются с помеченными гистидином белками
Перспективы
Наночастицы с защитным монослоем являются универсальной основой для создания биомакромолекулярных рецепторов. Поверхностные свойства этих систем могут модифицироваться за счет введения функциональных лигандов. Одной из областей, где такие системы особенно эффективны, являются рецепторы с многочисленными участками слабого взаимодействия, которые могут воспользоваться преимуществами взаимодействия в области многовалентного связывания. Такое биомиметическое связывание обеспечивается размером, формой и способностью монослоев наночастиц создавать темплаты.
Как подчеркивалось в настоящем обзоре, были продемонстрированы взаимосвязи, основанные на высокой степени сродства между наночастицами и биомакромолекулами. Такое взаимодействие бывает двух видов: (i) использование от природы присущих высоких степеней сродства, например, биотин-стрептавидин, и (ii) многовалентные взаимодействия простых лигандов, в особенности, имеющих элементы электростатического распознавания. Основной возможностью для первого подхода является создание монослоя, который становится активным участником процесса связывания. При использовании многовалентного подхода, напротив, основной задачей является специфичность. Дальнейшие исследования в области проектирования и создания темплатов помогут выполнить эту задачу. Тем не менее, следует отметить, что, даже если с помощью этих систем и не достигается настоящей специфичности, имеется целый ряд применений, включая, измерение, доставку стабилизацию белка/нуклеиновой кислоты, где селективности достаточно для того, чтобы производить высокоэффективные материалы. Однако, тем не менее, для всех этих применений требуется создание интерфейса наночастицы. Это благодатная почва для приложения усилий, требующая сочетания синтетических навыков с фундаментальным пониманием науки о пограничных связях. Еще многое предстоит узнать, и нас еще ожидает немало сюрпризов в деле изучения связей между поверхностями сложных наночастиц и еще более сложных биомакромолекул.
Интерфейс биомакромолекула-наночастица: создание и взаимодействие с ДНК (часть I)
Чанг-Ченг Ю, Апиват Чомпоосор и Винсент М. Ротелло, Химический Факультет Массачусетского Университета, США.