ФЕНОЛ: свойства и технология производства
Фено́л (оксибензол, устар. карболовая кислота) C6H5OH —кристаллическое, бесцветное вещество с характерным запахом.. На воздухе легко окисляется, приобретая вначале розовую, затем бурую окраску. Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне.
 Свойства продукта и технические характеристики
Свойства продукта и технические характеристики
Фенол был открыт в 1834 году немецким химиком – органиком Фридлибом Рунге, обнаружившим его при перегонке каменноугольной смолы. Состав вещества был определён лишь в 1842 году Огюстем Лораном. Он же обнаружил кислотные свойства фенола, но считал его спиртом и предложил назвать фенолом.
Фенол ядовит. Пыль и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Обладает слабокислотными свойствами, при действии щелочей образует соли — феноляты. При действии брома образуется трибромфенол, который используют для получения антисептика — ксероформа. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами в результате которых получаются полимерные продукты.
Физические свойства фенолаМолекулярная формула | C6H6O |
| Относительная молекулярная масса | 94,11 а. е. м. |
| Температура плавления | 40.5 °C |
| Температура кипения | 181.7 °C |
| Плотность | 1,07 г/см3 |
| Регистрационный номер CAS | 108-95-2 |
Фенол по железной дороге транспортируют в соответствии с правилами перевозок грузов в цистернах, снабженных устройством для обогрева. Цистерны должны быть изготовлены из нержавеющей хромоникелевой стали, углеродистой стали с цинковым покрытием или углеродистой стали. Фенол, предназначенный для производства медицинских препаратов, транспортируют в железнодорожных цистернах из нержавеющей хромоникелевой стали и углеродистой стали с цинковым покрытием. Фенол транспортируют также по обогреваемому трубопроводу, изготовленному из нержавеющей хромоникелевой стали.
Фенол в расплавленном и твердом состоянии хранят в герметичных резервуарах из нержавеющей хромоникелевой стали, углеродистой стали, покрытой цинком, или из углеродистой стали, а также в емкостях из монолитного алюминия. Допускается хранить фенол в расплавленном состоянии под азотом (объемная доля кислорода в азоте не должна превышать 2 %) при температуре (60 ± 10) °С в течение 2-3 сут. при хранении в емкостях из алюминия необходимо строго контролировать температуру во избежание растворения алюминия в продукте.
В зависимости от технологии производства и назначения фенол выпускают трех марок: А, Б и В по ГОСТ 23519-93. Ниже представлены его технические характеристики.
Технические характеристики фенола согласно ГОСТ 23519-93
Наименование показателя | Значение | ||
| Марка А | Марка Б | Марка В | |
| Внешний вид | Белое кристаллическое вещество | Белое кристаллическое в-во. Допускается розоватый или желтоватый оттенок | |
| Температура кристаллизации, °С, не ниже | 40,7 | 40,6 | 40,4 |
| Массовая доля нелетучего остатка, %, не более | 0,001 | 0,008 | 0,01 |
| Оптическая плотность водного раствора фенола (8,3 г марки А, 8,0 г марки Б, 5,0 г марки В в 100 см3 воды) при 20 °С, не более | 0,03 | 0,03 | 0,03 |
| Оптическая плотность сульфированного фенола, не более | 0,05 | Не нормируют | |
| Цветность расплава фенола по платиново-кобальтовой шкале, единицы Хазена: | |||
| у изготовителя, не более | 5 | Не нормируют | |
| у потребителя: | |||
| при транспортировании по трубопроводу и в цистернах из нержавеющей стали, не более | 10 | То же | |
| при транспортировании в цистернах из углеродистой стали и оцинкованных, не более | 20 | >> | |
| Массовая доля воды, %, не более | 0,03 | Не нормируют | |
| Массовая доля суммы органических примесей, %, не более | 0,01 | Не нормируют | |
| в том числе оксида мезитила, %, не более | 0,0015 | 0,004 | Не нормируют |
| суммы -метилстирола и изопропилбензола (кумола), %, не более | Не нормируют | 0,01 | То же |
Области применения фенола
После открытия фенола, применение ему нашли быстро — для дубления кож, в производстве синтетических красителей. Затем основным потребителем фенола на какое-то время стала медицина. Развитие производства фенопластов в конце 19-го века, в первую очередь фенол- формальдегидных смол, дало активный толчок развитию рынка фенола. В годы первой мировой войны фенол широко использовался для производства сильного взрывчатого вещества — пикриновой кислоты.
Разбавленные водные растворы фенола (карболка (5%)) применяют для дезинфекции помещений, белья. Являясь антисептиком, широко применялся в европейской и американской медицине в период 2 мировой войны, но из-за высокой токсичности в настоящее время использование сильно ограничено. Широко используется в молекулярной биологии и генной инженерии для очистки ДНК. В смеси с хлороформом ранее использовался для выделения ДНК из клетки. В настоящее время этот метод не актуален, из-за наличия большого количества специализированых китов для выделения.
В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств. Большинство этих лекарств — производные получаемой из фенола салициловой кислоты: o-HOC6H4COOH. Самое распространенное жаропонижающее — аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол. При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК). Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
Другое направление применения фенола – производство синтетических волокон: нейлона, капрона. Но важнейшая область его применения – производство феноло-формальдегидных смол.
Также фенол применяется для производства присадок к маслам, для селективной очистки масел, ортокрезола и для других целей, он входит в состав некоторых красителей, парфюмерных продуктов, пластификаторов для полимеров, средств защиты растений.
В целом основные направления использования фенола можно представить следующим образом:
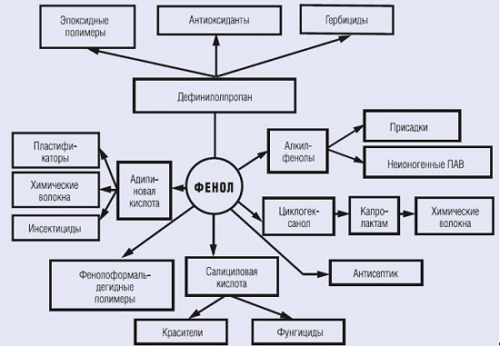
Рис. 1.5. Основные направления использования фенола
Источник: Евразийский химический рынок
Технологии производства
 История фенола насчитывает уже более 160 лет. Впервые он был выделен из каменноугольной смолы в 1834 г., откуда и получил свое название - карболовая (угольная) кислота. Быстрый рост потребления фенола поставил вопрос об искусственных способах его получения, создание которых является одной из самых ярких страниц в истории органической химии. Синтетические методы синтеза фенола различаются природой используемого сырья, химизмом и экономичностью процесса.
История фенола насчитывает уже более 160 лет. Впервые он был выделен из каменноугольной смолы в 1834 г., откуда и получил свое название - карболовая (угольная) кислота. Быстрый рост потребления фенола поставил вопрос об искусственных способах его получения, создание которых является одной из самых ярких страниц в истории органической химии. Синтетические методы синтеза фенола различаются природой используемого сырья, химизмом и экономичностью процесса.
Они могут быть подразделены на:
- сульфонатный, состоящий в щелочном плавлении бензолсульфокислоты (1);
- хлорные, заключающиеся в щелочном или воднопаровом гидролизе хлорбензола (2);
- окислительные, основанные на окислении до фенола бензола, толуола и циклогексана (3, 4, 5, 6, 7).
Из синтетических методов производства фенола про- мышленное значение имеют следующие:
- каталитическое окисление толуола (4) - прямое окисление бензола в среде уксусной кислоты (7)
- окислительное хлорирование бензола (3)
- кумольный метод совместного производства фенола и ацетона через изопропилбензол (6);
- из бензола через циклогексан (5).
На рисунке показана взаимосвязь различных методов производства фенола, а в таблице под теми же номерами приведены их технико-экономические показатели (в % относительно сульфонатного метода).
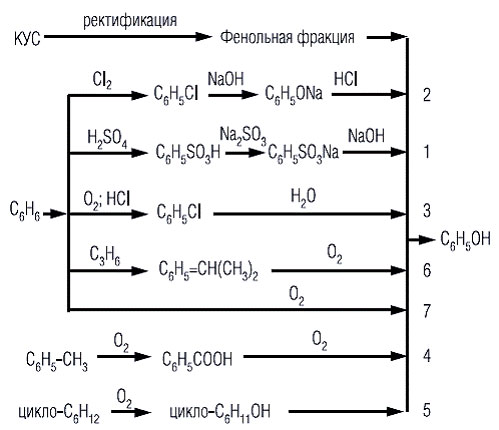
Рис. 1.1. Методы производства фенола
Таблица 1.3
Технико-экономические показатели производства фенола| Методы | ||||||
| Показатель | 1 | 2 | 3 | 4 | 5 | 6 |
| Капитальные затраты | 100 | 83 | 240 | 202 | 208 | 202 |
| Стоимость сырья | 100 | 105 | 58 | 69 | 72 | 45 |
| Себестоимость | 100 | 96 | 70 | 73 | 76 | 56 |
Таким образом, наиболее целесообразным с экономической точки зрения является наиболее востребованный в настоящее время кумольный процесс. Ниже кратко описаны промышленные процессы, которые в то или иное время использовались для получения фенола.
1. Сульфонатный процесс был первым фенольным процессом, реализованным в промышленном масштабе фирмой «BASF» в 1899 г. Этот метод основан на сульфировании бензола серной кислотой с последующим щелочным плавлением сульфокислоты. Несмотря на применение агрессивных реагентов и образование большого количества отходов сульфита натрия, данный метод использовался в течение почти 80 лет. В США это производство было закрыто лишь в 1978 году.
2. В 1924 г. фирмой «Dow Chemical» был разработан процесс получения фенола, включающий реакцию хлорирования бензола и последующий гидролиз монохлорбензола (процесс каталитического гидролиза галогензамещенных бензолов). Независимо аналогичная технология была разработана немецкой фирмой «I.G. Farbenindustrie Co». Впоследствии стадия получения монохлорбензола и стадия его гидролиза были усовершенствованы, и процесс получил название «процесс Рашига». Суммарный выход фенола по двум стадиям составляет 70-85%. Данный процесс был основным методом получения фенола в течение нескольких десятилетий.
3. Циклогексановый процесс, разработанный фирмой «Scientific Design Co.», основан на окислении циклогексана в смесь циклогексанона и циклогексанола, которая далее дегидрируется с образованием фенола. В 60-е годы фирма «Monsanto» в течение нескольких лет использовала этот метод на одном из своих заводов в Австралии, однако в дальнейшем перевела его на кумольный способ получения фенола.
4. В 1961 г. фирмой «Dow Chemical of Canada» был реализован процесс через разложение бензойной кислоты, это единственный способ синтеза фенола, основанный на использовании небензольного сырья. Обе реакции протекают в жидкой фазе. Первая реакция. окисление толуола. использовалась в Германии уже в период Второй мировой войны для получения бензойной кислоты. Реакция протекает в довольно мягких условиях с высоким выходом. Вторая стадия является более трудной вследствие дезактивации катализатора и низкой селективности по фенолу. Полагают, что проведение этой стадии в газовой фазе может сделать процесс более эффективным. В настоящее время этот метод используется на практике, хотя его доля в мировом производстве фенола составляет лишь около 5%.
5. Метод синтеза, по которому в наши дни получают большую часть производимого в мире фенола – кумольный процесс – открыт группой советских химиков во главе с профессором П. Г. Сергеевым в 1942 году. Метод основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной серной кислотой. В 1949 году в г. Дзержинске Горьковской области был введен в действие первый в мире кумольный завод. До этого гидроперекиси считались малостабильными промежуточными продуктами окисления углеводородов. Даже в лабораторной практике их почти не использовали. На Западе кумольный метод был разработан в конце 40-х годов и отчасти известен как процесс Хока, по имени немецкого ученого, позднее независимо открывшего кумольный путь синтеза фенола. В ромышленном масштабе этот метод стал впервые использоваться в США в начале 50-х годов. С этого времени на многие десятилетия кумольный процесс становится образцом химических технологий во всем мире.
Несмотря на прекрасно отлаженную технологию и длительный опыт эксплуатации, кумольный метод имеет ряд недостатков. Прежде всего это наличие взрывоопасного промежуточного соединения (гидропероксид кумола), а также многостадийность метода, что требует повышенных капитальных затрат и делает труднодостижимым высокий выход фенола в расчете на исходный бензол. Так, при выходе полезного продукта 95% на каждой из трех стадий итоговый выход составит лишь 86%. Приблизительно такой выход фенола и дает кумольный метод в настоящее время. Но самый важный и принципиально неустранимый недостаток кумольного метода связан с тем, что в качестве побочного продукта образуется ацетон. Это обстоятельство, которое первоначально рассматривалось как сильная сторона метода, становится все более серьезной проблемой, поскольку ацетон не находит эквивалентного рынка сбыта. В 90-х годах эта проблема стала особенно ощутимой после создания новых способов синтеза метилметакрилата путем окисления углеводородов С4, что резко сократило потребность в ацетоне. Об остроте ситуации говорит тот факт, что в Японии разработана технология, предусматривающая рецикл ацетона. С этой целью к традиционной кумольной схеме добавляются еще две стадии, гидрирование ацетона в изопропиловый спирт и дегидратация последнего в пропилен. Образующийся пропилен снова возвращают на стадию алкилирования бензола. В 1992 году фирма «Mitsui» пустила крупное производство фенола (200 тыс. т/год), основанное на этой пятистадийной кумольной технологии.
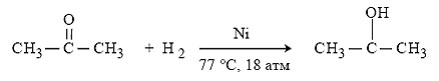
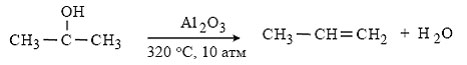
Рис. 1.2. Рецикл ацетона с получением пропилена
Предлагаются также другие сходные модификации кумольного метода, которые позволили бы смягчить проблему ацетона. Однако все они приводят к значительному усложнению технологии и не могут рассматриваться как перспективное решение проблемы. Поэтому исследования, ориентированные на поиск новых путей синтеза фенола, которые основывались бы на прямом окислении бензола, в последнее десятилетие приобрели особенно интенсивный характер. Работы ведутся главным образом в следующих направлениях: окисление молекулярным кислородом, окисление моноатомными донорами кислорода и сопряженное окисление. Рассмотрим более подробно направления поиска новых путей синтеза фенола.
Окисление молекулярным кислородом. Прямое окисление бензола молекулярным кислородом представляется наиболее привлекательным методом получения фенола. Однако это на первый взгляд самое простое и очевидное решение проблемы оказалось чрезвычайно трудной задачей. Работы по окислению бензола с помощью О2 начались еще до того, как в 1865 г. Кекуле предложил структурную формулу бензольного кольца. С тех пор многочисленные попытки найти эффективный путь для проведения этой реакции не прекращаются. Окисление бензола ведут как в жидкой, так и в газовой фазах, при низком и высоком давлениях, в отсутствие и в присутствии разнообразных катализаторов. Несмотря на отдельные успехи, результаты этих работ пока далеки от практического применения. Начиная с 80-х годов, значительные усилия предпринимаются для проведения этой реакции в жидкой фазе с использованием в качестве катализаторов различных комплексов переходных металлов, среди которых наибольшую активность проявляют соединения Pd и Cu. Однако после нескольких оборотов реакция, как правило, прекращается вследствие деградации катализатора.
Моноатомные доноры кислорода. Более успешные результаты дает применение в качестве окислителей так называемых моноатомных доноров кислорода в виде различных кислородсодержащих молекул. Среди таких молекул наибольшее внимание привлекает пероксид водорода:

Окисление с помощью Н2О2 проводят в присутствии солей и комплексов переходных металлов, в том числе инкапсулированных в матрице цеолита. Исследования в данной области приобрели особенно интенсивный характер после открытия цеолитов состава Ti-Si (TS-1) и их уникальных свойств в реакциях жидкофазного окисления с помощью пероксида водорода. На этой основе фирмой «Enichem» разработан промышленный процесс получения гидрохинона и пирокатехина путем гидроксилирования фенола. Вслед за цеолитами TS-1 были опробованы разнообразные цеолитные системы, содержащие как титан, так и другие переходные металлы. Однако, в отличие от окисления фенола, ароматическое кольцо которого активировано присутствием ОН-группы, окисление бензола протекает менее активно и со значительно меньшей селективностью по пероксиду водорода вследствие его побочного разложения на кислород и воду. Следует отметить, что в любом случае данная реакция едва ли перспективна для практического использования из-за высокой стоимости Н2О2 (по сравнению со стоимостью фенола). Помимо пероксида водорода, в исследовательских целях применяется ряд других, более сложных и дорогостоящих монокислорододонорных окислителей. Более вероятным окислителем для бензола с практической точки зрения представляется азотная кислота, которая впервые была использована для этой цели в 1925 г. В более поздних работах было показано, что эффективными катализаторами этой реакции являются оксидные системы на основе V2O5 и MoO3.
Сопряженное окисление. Пероксид водорода может непосредственно образовываться в реакционной системе in situ и тут же расходоваться на окисление субстрата. Этот подход рассматривается как одно из наиболее перспективных направлений не только для окисления ароматических соединений, но и многих других углеводородов, включая парафины. Использование пероксида по мере его образования из Н2 и О2 позволяет значительно увеличить селективность полезного использования H2O2. Работы в этом направлении интенсивно ведутся во многих лабораториях мира с использованием разнообразных катализаторов и приемов. Наиболее эффективные катализаторы включают платину или другой благородный металл, который вместе с оксидом ванадия наносится на силикагель. На таком катализаторе в растворе уксусной кислоты бензол почти со 100%-ной селективностью окисляется в фенол. Однако селективность реакции по водороду все еще остается невысокой и составляет 10-15%.
Недостаток сопряженных реакций состоит в трудности подбора таких условий, которые были бы оптимальными как для образования сопрягающего промежуточного соединения в первичной реакции, так и для его эффективного использования во вторичной реакции. В последние годы широкое развитие получают работы по исследованию реакций сопряженного окисления углеводородов в электрохимических ячейках, представляющих собой реакторы типа топливных элементов. Проведение реакций в таких устройствах открывает дополнительную возможность для управления реакцией посредством регулирования электрического тока, пропускаемого через ячейку.
В качестве примера современной одностадийной технологии получения фенола можно привести газофазную одностадийную технологию путем прямого окисления бензола закисью азота в адиабатическом реакторе с цеолитсодержащим катализатором (ALPHOX процесс, рис. В). Исходная закись азота может быть получена путем окисления аммиака воздухом, либо выделена из побочных продуктов синтеза адипиновой кислоты. Технология обеспечивает производство высокочистого фенола с суммарным содержанием примесей менее 50 ppm. AlphOx процесс отработан на пилотном заводе фирмы Solutia Inc. (США, г. Пенсакола). Рассматривалась возможность реализации данного процесса в производстве капролактама на ЗАО «Куйбышевазот».
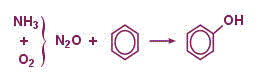
Рис.1.3. Схема AlphOx процесса
Некоторые специалисты считают, что новая технология является реальной альтернативой используемому в промышленности кумольному процессу получения фенола.
В качестве преимуществ данной технологии по сравнению с кумольной схемой называются:
• отсутствие побочного продукта (ацетона);
• снижение капитальных затрат на 30 %;
• уменьшение расхода бензола на 15—20 %;
• уменьшение смолообразования более чем в 3 раза;
• возможность выделения из смолы ценного продукта – гидрохинона;
• высокая безопасность и экологичность процесса.
Таблица 1.4.
Технические характеристики ALPHOX процесса
| Показатели | Значения |
| Температура, °C | 400—450 |
| Время контакта, с | 1—2 |
| Степень превращения: • бензола в фенол, % (мол) • бензола в двухатомные фенолы, % (мол) • закиси азота в фенол, % | 97—98 1 85 |
| Производительность по фенолу, кг/кг (кат) ч | 0,4 |
| Расход сырья на 1 т фенола (N2O из NH3): ▪ бензол, кг ▪ аммиак, кг | 800 600 |
Стоит отметить возможность производства фенола в микрореакторе. Один из его вариантов включает в себя малую в диаметре (2мм), пористую алюминиевую трубку, покрытую слоем палладия. Смесь бензола и кислорода пропускается через трубу, в которую поступает водород.
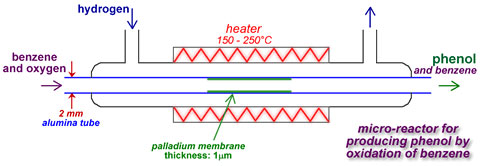
Рис. 1.4. Схема синтеза фенола в микрореакторе
Трубка нагревается до 150 - 250°C. Водород проходит черед алюминиевую трубку и превращается в атом водорода на палладиевом катализаторе. Атомный водород реагирует с кислородом, атом кислорода в свою очередь вступает в реакцию с бензолом с образованием пероксида бензола, который изомеризуется в фенол. Существенная разница в температурах кипения бензола и фенола позволяет легко отделить фенол от непрореагировавшего бензола. Данный метод позволяет снизить капитальные затраты при строительстве производства, снижает его энергоемкость, выбросы вредных веществ. При необходимости производство можно легко расширить добавить дополнительные трубки. Один микрореактор позволяет выпускать до 100 тыс. тонн фенола в год.
В целом можно сказать, что сейчас доля коксохимического фенола составляет менее 5% от общего количества. Остальное количество производят синтетическим путем. Кроме кумольного метода, фенол получают сплавлением фенолсульфокислого натрия с едкой щелочью, гидролизом хлорбензола при высоком давлении, окислением бензола и толуола. Таким образом, методов получения фенола известно много, работы по разработке новых технологий синтеза ведутся постоянно, но на сегодняшний день наиболее востребованным и широко распространенным является кумольный способ синтеза фенола.
Подробнее с текущей ситуацией и прогнозом развития российского рынка фенола и ацетона можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Рынок фенола и ацетона в России».
Автор:
Академия Конъюнктуры Промышленных Рынков
Тел.: (495) 918-13-12, (495) 911-58-70
E-mail: mail@akpr.ru
WWW: www.akpr.ru
Об авторе:
Академия Конъюнктуры Промышленных Рынков оказывает три вида услуг, связанных с анализом рынков, технологий и проектов в промышленных отраслях - проведение маркетинговых исследований, разработка ТЭО и бизнес-планов инвестиционных проектов.
• Маркетинговые исследования
• Технико-экономическое обоснование
• Бизнес-планирование