ТЕРЕФТАЛЕВАЯ КИСЛОТА: применение, свойства, получение

Области применения терефталевой кислоты
Из терефталевой кислоты синтезируют прозрачный термостойкий полимер полиэтилентерефталат. Его получают в результате поликонденсации этиленгликоля с терефталевой кислотой. Из него делают бутылки, полиэфирное волокно терилен (другое, более распространенное название – лавсан является сокращением от «ЛАборатория Высокомолекулярных Соединений Академии Наук»), упаковочные материалы, в том числе для пищевой промышленности, радиодеталей, химического оборудования
Для получения ПЭТФ пищевого назначения большое значение имеет содержание в ТФК примесей — продуктов неполного окисления параксилола, то есть необходима терефталевая кислота марки А, с минимальным содержанием примесей.
Исходя из этого, объемы производства терефталевой кислоты определяются в основном спросом со стороны производителей полиэфирной продукции. При этом спрос на ПЭТ пищевого назначения будет ниже по сравнению со спросом продукта на полиэтилентерефталат для производства.
Большое значение имеют эфиры терефталевой кислоты – диэтилтерефталат и диметилтерефталат.
В настоящее время довольно много крупных фирм в мире работают над проблемой получения диметилтерефталата в основном двумя путями:
1) этерификация метанолом «сырой» терефталевой кислоты (американские фирмы «Eastman Kodak», «Du Pont», японские «Toray Industries», «Kararay Vuka» и др.);
2) окисление параксилола до п-терефталевой кислоты, ее этерификация метанолом, последующее окисление метильной группы до кислотной и превращение в диметилтерефталат или совместное окисление параксилола, метилового эфира п-терефталевой кислоты и монометилового эфира терефталевой кислоты и последующая их этерификация.
Диметиловый эфир терефталевой кислоты является одним из важнейших химических продуктов, используемых для производства полиэфирных волокон, полиоксадиазолов, полибензимидазолов, алкидных смол и пластификаторов.
Можно утверждать, что терефталевая кислота и диметиловый эфир терефталевой кислоты являются важнейшими мономерами для производства полиэфирных. Одновременно они являются конкурентами за право считаться основным исходным мономером. До середины восьмидесятых годов производство диметилтерефталата было намного больше, чем производство терефталевой кислоты. Но в последнее десятилетие были разработаны способы получения ТФК высокой частоты, поэтому сейчас производство обоих материалов находится на довольно высоком уровне.
В отличие от полиэтилентерефталата, прежде всего известного своим применением в текстильной промышленности (полиэфирные волокна) и производстве пластиковых бутылок, ПБТ получил широкое распространение, именно, как конструкционный пластик. Области его применения включают машиностроение, автомобильную промышленность, электротехнику и электронику, радиотехнику, точную механику, бытовую технику, товары широкого потребления.
Полибутилентерефталат получают в две стадии по периодической или непрерывной схеме. На первой стадии синтезируют бис-(4-гидроксибутил)терефталат, на второй - проводят поликонденсацию. Бис-(4-Гидроксибутил)терефталат получают этерифика-цией терефталевой кислоты или переэтерификацией диметилтерефталата (этот метод преобладает в промышленности) 1,4-бутилен-гликолем.
Свойства терефталевой кислоты
Таблица 1. Терефталевая кислота: синонимы и сокращения
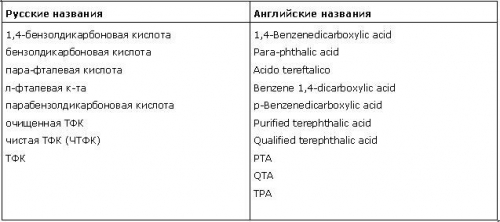
Терефталевая кислота (ТФК) - бесцветное кристаллическое вещество, слабо растворима в воде, спиртах, диметилсульфоксиде. Терефталевая кислота представляет собой чистый белый порошок, получаемый путем окисления параксилола при наличии катализаторов и уксусной кислоты. Не образует мономерного ангидрида; при нагревании с уксусным ангидридом превращается в полимерный ангидрид. Взаимодействие терефталевой кислоты со спиртами приводит к образованию эфиров, из которых наиболее практическое значение имеет диметилтерефталат.
Таблица 2. Свойства терефталевой кислоты
CAS-номер | 100-21-0 |
Брутто-формула (система Хилла) | C8H6O4 |
Формула в виде текста | п-C6H4(COOH)2 |
Температура самовоспламенения, °C | 496 |
Температура вспышки, °C | 260 |
Молекулярная масса (в а.е.м.) | 166,14 |
Удельная плотность (плотность по воде), г/см3 при 20°C | 1.51 |
Растворимость в воде (г/100 мл при 20°C) | 0.28 |
Теплота сгорания Qp (кДж/моль) | 3223,3 |
Давление пара, Па при 20°C | <1 |
ТЕХНОЛОГИИ ПРОИЗВОДСТВА
Получение
Основные методы синтеза терефталевой кислоты:
1) жидкофазное окисление п-ксилола в CH3COOH (175-230 °C, 1.5-3.0 МПа, катализатор - соли Co и Mn) в течение 0.5-3 ч; выход 95%, содержание основного вещества 99.5%. Технический продукт от примеси 4-формилбензойной кислоты очищают гидрированием при высокой температуре и давлении в присутствии Pd/C или Pt/C с последующим отделением получающейся п-толуиловой кислоты кристаллизацией.
2) Окисление п-ксилола разбавленной H2SO4 в уксусной кислоте в присутствии Cr2O3.
3) Окисление нафталина во фталевый ангидрид с последующим превращением его в дикалиевую соль о-фталевой кислоты и изомеризацией при 350-450 °C и давлении CO2 1-5 МПа в дикалиевую соль терефталевой кислоты с последующим ее подкислением разбавленной H2SO4.
Процесс получения технической ТФК состоит из следующих основных стадий:
– подготовка сырья;
– окисление;
– фильтрация и сушка терефталевой кислоты;
– транспортирование ТФК и очистка отработанного газа;
– регенерация растворителя;
– регенерация катализатора;
– вспомогательные операции.
Процесс получения чистой ТФК (ЧТФК) состоит из следующих основных стадий:
– приготовление исходной смеси;
– гидрирование;
– кристаллизация;
– фильтрация и сушка чистой ТФК;
– транспортирование и расфасовка чистой ТФК.
Технология производства
Процесс получения чистой терефталевой кислоты состоит из двух этапов:
1) Окисление параксилола в растворителе кислородом воздуха в присутствии
катализаторов.
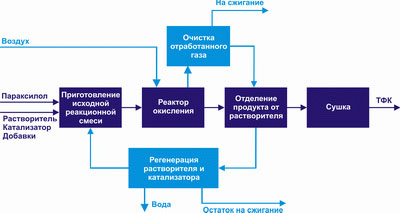
2) Очистка технической терефталевой кислоты методом гидрирования примесей в водном растворе ТФК водородом на катализаторе - палладий на угле.