СВОЙСТВА АМИННЫХ АНТИДЕТОНАТОРОВ
С целью повышения октанового числа (ОЧ) и улучшения экологии двигателей внутреннего сгорания применяются азотсодержащие соединения класса аминов.

Хотя эти добавки и уступают по эффективности присадкам на основе элементорганических соединений железа и марганца (дициклопентандиенил железа, метил-циклопентадиенилтрикарбонил марганца и пр.), однако, значительно превосходят кислородсодержащие добавки (низшие спирты, метилтретбутиловый эфир или его смеси с трет-бутанолом и др.). Азотсодержащие соединения являются беззольными присадками и тем выгодно отличаются от присадок на основе металлорганических соединений. Наконец, одним из важных преимуществ является их многофункциональность. Так, будучи достаточно эффективными антидетонаторами, амины обладают также антиокислительными, стабилизирующими и антикоррозионными свойствами.
Настоящая работа посвящена:
- выяснению механизма действия аминов при использовании различных бензинов в камере сгорания;
- анализу сравнительной эффективности различных аминов в зависимости от их молекулярной структуры;
- выяснению возможности прогнозирования для практического применения наиболее эффективных соединений, не уступающих или даже превосходящих такие известные антидетонаторы как анилин или монометиланилин.
Исходным пунктом является положение, вытекающее из теории цепных процессов, что над поршнем проходят процессы слишком бурного развития предпламенных реакций при переходе горения к взрыву и детонации продуктов сгорания, в результате которых накапливается слишком много активных радикалов-продолжателей или разветвителей цепи.
Развитие цепей [1] во времени n(t) зависит от соотношения вероятностей обрыва (b) и продолжения цепи (а). Поэтому, естественно, в топливном заряде, процесс нарастания скорости реакции до критической, тесно связан с соотношением этих вероятностей:
![]()
где: n0 - начальная концентрация радикалов
Естественно, что для каждой группы топлив процесс нарастания скорости реакции до критической тесно связан со своим соотношением этих вероятностей.
Для целей увеличения детонационной стойкости топлива необходимо вводить такие присадки, которые являются «ловушками» радикалов, увеличивающими вероятность обрыва цепи, что приведет к спокойному протеканию горения топливного заряда. Т.е. эффективность той или иной присадки будет полностью определяться значением вероятности (b).
В силу резкого экспоненциального нарастания или, соответственно, торможения реакции, даже малые доли их в увеличении вероятности (b) приводят к резкому торможению процесса и, соответственно, увеличению времени достижения скорости нарастания числа радикалов n(t) по формуле (1) до критической (см. рис. 1).
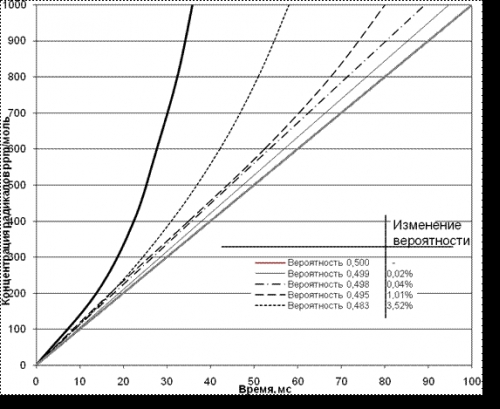
Рис. 1. Нарастание концентрации радикалов в зависимости
от вероятности обрыва цепи (b)
Авторы безмоторного экспресс-метода оценки ОЧ [6-7] экспериментально установили, что период индукции самовоспламенения топливного заряда хорошо коррелирует с ОЧ, причем здесь обоснована симбатная корреляция между этими параметрами. Из соотношения (1) для малых времен легко получить связь между временем индукции самовоспламенения τ и начальной концентрацией радикалов n0.
![]()
где: С - критическая скорость реакции в момент вспышки, своя для каждого двигателя.
Тем самым и устанавливается антибатная корреляция уже непосредственно между периодом индукции и величиной no, а стало быть, в конце концов, аналогичная корреляция между ОЧ и no. Так, увеличение стартовой концентрации (no) в два-три раза приводит к пропорциональному уменьшению времени нарастания реакции до критической. Это обстоятельство объясняет физический смысл октанового числа (ОЧ) различных топлив. Действительно, увеличение начальной концентрации (no) радикалов прямо связано с сокращением времени достижения критической скорости горения, что и определяет уменьшение ОЧ топлив.
Как следует из соотношения (1) и видно на рис. 2 в самом начале цепного процесса продолжения цепи концентрация активных радикалов n(t) пропорциональна времени, а скорость нарастания реакции до критической существенно зависит от начальной «затравочной» концентрации радикалов no. Исходные радикалы возникают в топливном заряде спонтанно, как малая доля активных высокоэнергетических частиц в распределении Максвелла или создаются искусственно, например, при освещении в фотохимических процессах.
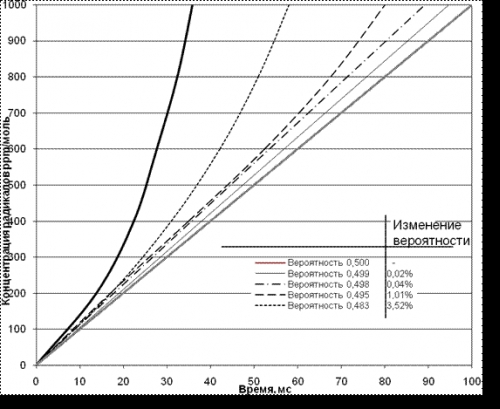
Рис. 1. Нарастание концентрации радикалов в зависимости
от вероятности обрыва цепи (b)
Авторы безмоторного экспресс-метода оценки ОЧ [6-7] экспериментально установили, что период индукции самовоспламенения топливного заряда хорошо коррелирует с ОЧ, причем здесь обоснована симбатная корреляция между этими параметрами. Из соотношения (1) для малых времен легко получить связь между временем индукции самовоспламенения τ и начальной концентрацией радикалов n0.
![]()
где: С критическая скорость реакции в момент вспышки, своя для каждого двигателя.
Тем самым и устанавливается антибатная корреляция уже непосредственно между периодом индукции и величиной no, а стало быть, в конце концов, аналогичная корреляция между ОЧ и no. Так, увеличение стартовой концентрации (no) в два-три раза приводит к пропорциональному уменьшению времени нарастания реакции до критической. Это обстоятельство объясняет физический смысл октанового числа (ОЧ) различных топлив. Действительно, увеличение начальной концентрации (no) радикалов прямо связано с сокращением времени достижения критической скорости горения, что и определяет уменьшение ОЧ топлив.
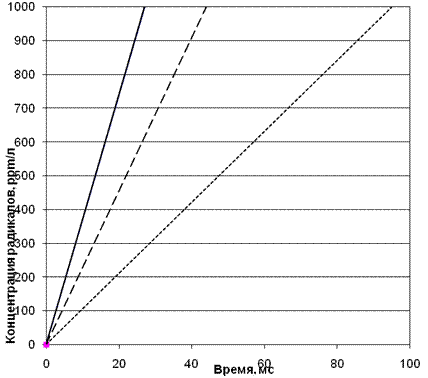
Рис. 2. Сокращение времени достижения критической скорости образования
радикалов при уменьшении ОЧ топлив и, соответственно, увеличения стартовой их концентрации n0==10, n02=20, n03=30
стартовая концентрация n0;
- - - - стартовая концентрация n02;
стартовая концентрация n03.
При дальнейшем анализе необходимо разделить топлива, для которых имеются экспериментальные данные по влиянию аминов на ОЧ. По этому параметру можно выделить три группы топлив:
1 – топлива с ОЧ 86-90 следует отнести к группе I с малым начальным значением n0;
2 топлива со средним значением ОЧ 60-70 к группе II с n02;
3 топлива с малым ОЧ 42 отнести к группе III с соответственно большим значением n03.
Как известно, активными частицами в процессе горения являются атомарный водород, радикалы гидроксила, перекись водорода, различные гидроперекиси и др. Все эти кинетические единицы или активизируют горение, ускоряя фронт распространения пламени, или ведут к продолжению и разветвлению цепей. Вводимые присадки должны являться «ловушками» для этих частиц.
Соотношение (2) устанавливало корреляцию для чистого беспримесного топлива. В случае добавления к топливу присадок необходимо учесть их влияние на ОЧ. Это нетрудно сделать. Действительно, если в соотношении (1) учесть три члена в разложении экспоненты в ряд, то легко получить следующую связь между периодом индукции и характеристиками радикалов начальной их концентрацией n0 и вероятностями продолжения и обрыва цепей:
![]()
где: a и b-вероятности продолжения и обрыва цепи.
Это соотношение отличается от (2) появлением нового слагаемого ![]()
и оно имеет прозрачный физический смысл. Во-первых, оно не зависит от условий горения в двигателе. Во-вторых, оно является характеристикой только радикала и только той присадки, которую мы вносим в топливо.
Присадки, увеличивающие вероятность (a), будут являться промоторами горения и будут уменьшать τ, а с ним и ОЧ (однако, увеличивать цетановое число для дизельных топлив). Присадки, увеличивающие вероятность (b), будут увеличивать период индукции τ и, в конечном счете, увеличивать ОЧ.
Так, сравнительно просто обстоит дело для модельного топлива (монотоплива, например, чистого гептана или изооктана). В реальном случае топлива представляют собой сложную смесь фракций углеводородов различной природы. Такая смесь углеводородов естественно будет вести себя при горении таким образом, что разные углеводороды будут иметь разную скорость превращения, и тогда интегральный – опытный период индукции будет определяться скоростью «ведущей» реакции, которых в процессе может быть несколько. В таком случае эффективный период индукции будет складываться из парциальных следующим образом:
![]()
И следуя идее авторов работы [6], можно сказать, что если ОЧ в линейном приближении симбатно периоду индукции, то для ОЧ можно найти следующее аналитическое выражение:
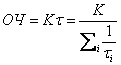
где: К коэффициент пропорциональности между периодом индукции и ОЧ,
τi парциальный период индукции,
i – номер затравочной цепи (n0i).
Как показывает опыт и такой модельный подход, регулирование режима горения топлив возможен подбором углеводородного состава бензинов или введением в него антидетонационных присадок.
Возвращаясь к нашему случаю воздействию аминов на горение топлива, скажем, что механизм этого процесса будет определяться влиянием присадки на радикал промотор. Присадка-«ловушка» связывает на некоторое время активный радикал и выключает его тем самым из процесса, что эквивалентно увеличению вероятности обрыва цепи (b).
В дальнейшем наше рассмотрение и будет опираться на процесс связывания этих активных частиц аминами, путем образования с ними связей как электростатического взаимодействия, так и образованием координационных и водородных связей, возникающих между протонами амина и атомами кислорода гидроперекисей, или протонами гидроперекисей и атомами азота в аминах. Ответ на вопрос: «Какие связи будут более вероятны?» должен дать статистический корреляционный анализ.
Из всего массива аминов (алифатические и ациклические, гетероциклические и ароматические) следует выбрать наиболее типичные группы. В качестве первого модельного приближения, целесообразно рассмотреть две большие группы, отличающиеся двумя характерными структурными признаками:
1 - первичные амины;
2 - вторичные амины.
Естественно, что при этом мы во многом отвлекаемся от более тонких физико-химических различий и молекулярных характеристик этих соединений, но, тем не менее, последующий анализ покажет правомочность такого приближения.
Рассмотрим влияние первичных аминов на октановые числа бензинов. Исходные экспериментальные данные по первичным аминам взяты из работ [2-4]. Все данные по присадкам пересчитаны на концентрацию 2% и нормированы на моль и представлены в табл. 1. Физико-химические характеристики отдельных соединений рассчитаны с использованием пакета прикладных программ ChemSiteSW [5] и даны в табл. 1.
Рассмотрим топлива группы II, для которых имеется большое количество экспериментальных данных по ОЧ для отдельных соединений. Приращение ОЧ для топлив с присадками различных аминов коррелировалось в зависимости от тех или иных молекулярных характеристик для выяснения подходов к расшифровке механизма действия аминов были проведены следующие феноменологические этапы корреляций прироста ОЧ:
- от молекулярной массы аминов (M) с коэффициентом корреляции равным 0,911;
- от величины, пропорциональной скорости теплового движения молекул (М0,5) c коэффициентом корреляции равным 0,907;
- от величины, пропорциональной относительной скорости (М0,5 М0 0,5) молекулярного движения «ловушки (молекулы амина)» (М) и скорости активных радикалов (М0) (гидроперекисей с молекулярной массой М0=40) с коэффициентом корреляции равным 0,907.
Возникающая неопределенность в выборе массы промотора связана с тем, что в процессе горения появляется целый спектр радикалов продолжателей цепей, и поэтому нужно учитывать весь этот спектр масс. Под параметром М0, таким образом, следует понимать некую молекулярную массу, усредненную по всем радикалам участвующим в процессе по предложенному механизму. Предлагаемая методика оперирует параметром, пропорциональным относительной скорости молекул:
![]()
где: М0 молекулярная масса молекулы промотора,
М молекулярная масса молекулы амина.
Нами для наиболее характерных аминов проведен корреляционный анализ для выявления наиболее вероятного представителя из большинства мыслимых промоторов. Из литературы [7, 8] известно, что к таковым могут быть отнесены О, НО, Н2О2, СН3OOH и др. с молекулярными массами соответственно М0 =16, 17, 34, 48 и более. Для всего массива аминов для топлива данной группы I варьировалось значение М0 с шагом равным 4 и рассчитывались значения коэффициентов корреляции. Полученные результаты показали (см. табл. 2), что коэффициент корреляции формирует широкую колоколообразную кривую с максимумом в районе молекулярной массы промотора равной 42. Отсюда можно сделать вывод, что для топлив данной группы в топливном заряде идут предпламенные цепные процессы, промоторами в которых участвуют практически все из указанных соединений, однако статистический вес перекиси водорода и гидроперекиси метана с массами 34 и 48 предпочтительнее по сравнению со всеми остальными.
Таким образом, результаты проведенного анализа показывают, что вероятнее всего амины улавливают чистую перекись водорода и радикал гидроперекиси метана. Механизм влияния аминов и в этом случае заключается в возникновении водородных связей между протонами амина и атомами кислорода перекисей
Таблица 1
Свойства первичных аминов
№ | Присадка | Мол. масса | Увеличение октанового числа при концентрации присадки 2% об. | DОЧ/моль х 100 | Увеличение ОЧ при концентрации присадки 0,1 моль | Lmax. диаметр | Rgрадиусинерции | dqNзарядана азоте | dqHзарядана водороде | |||||
| I группа топлив | II группа топлив | III группа топлив | I группа топлив | II группа топлив | I группа топлив | |||||||||
| ОЧМ | ОЧИ | ОЧМ | ОЧМ | ОЧИ | ОЧМ | ОЧИ | ||||||||
| 1 | Анилин | 93,1 | 4,6 | 14 | 3,7 | 4,95 | 15 | 2,8 | 4,5 | 6,020 | 1,787 | -0,863 | 0,352 | |
| 2 | Толуидины (смесь) | 107,2 | 5,1 | - | 4,1 | 4,25 | - | - | - | |||||
| 3 | п-Толуидин | 107,2 | - | 14 | - | - | 13,1 | - | - | 6,917 | 2,036 | -0,863 | 0,352 | |
| 4 | м-Толуидин | 107,2 | - | 9 | - | - | 8,4 | - | - | 6,726 | 1,990 | -0,863 | 0,352 | |
| 5 | о-Толуидин | 107,2 | 5,1 | 7 | 4,1 | - | 6,55 | - | - | 5,930 | 1,912 | -0,863 | 0,352 | |
| 6 | 1,3 пропандиамин | 74,1 | 2,80 | - | - | 3,78 | - | - | - | 5,176 | 1,994 | -0,539 | 0,224 | |
| 7 | м-Ксилидин | 121,2 | 3,6 | - | 2,4 | 2,97 | - | - | - | 6,170 | 2,184 | -0,863 | 0,352 | |
| 8 | п-Ксилидин | 121,2 | 3,4 | - | 2,2 | 2,8 | - | - | - | 6,894 | 2,162 | -0,863 | 0,352 | |
| 9 | Этилендиамин | 58,1 | 1,6 | - | - | 2,75 | - | - | - | 3,819 | 1,424 | -0,528 | 0,228 | |
| 10 | 1,4 бутандиамин | 88,1 | 2,0 | - | - | 2,7 | - | - | - | 6,531 | 2,190 | -0,539 | 0,224 | |
| 11 | трет-Бутиламин | 73,1 | 2,4 | - | 0,8 | 1,98 | - | - | - | 5,027 | 1,525 | -0,542 | 0,223 | |
| 12 | о-Ксилидин | 121,2 | 1,04 | - | - | 1,4 | - | - | - | 6,606 | 2,046 | -0,863 | 0,351 | |
| 13 | Метиламин | 31,1 | - | - | - | - | - | 0,6 | 2,62 | 2,381 | 0,906 | -0,537 | 0,225 | |
| 14 | Этиламин | 45,1 | - | - | - | - | - | 0,4 | 1,33 | 4,173 | 1,241 | -0,539 | 0,224 | |
| 15 | Н-бутиламин | 73,1 | - | - | - | - | - | 0 | 0 | 6,110 | 1,855 | -0,539 | 0,224 | |
| 16 | Изопропиламин | 59,1 | - | - | - | - | - | 0,4 | 1 | 4,1823 | 1,419 | -0,541 | 0,223 | |
| 17 | Бензиламин | 107,2 | 0,56 | - | - | 0,5 | - | - | - | 6,000 | 2,017 | -0,538 | 0,224 | |
| 18 | Изобутиламин | 73,1 | - | 2,4 | - | - | 5,4 | - | - | 4,720 | 1,692 | -0,539 | 0,224 | |
| 19 | Циклогексиламин | 99,2 | - | - | - | - | 2,3 | - | - | 4,970 | 1,702 | -0,541 | 0,223 | |
| 20 | трет-Октиламин | 129,2 | 0,33 | - | - | 0,25 | - | - | - | 5,534 | 2,138 | -0,542 | 0,223 | |
| 21 | 2-Этилгексиламин | 129,2 | - | 0,3 | - | - | 0,23 | - | - | 8,510 | 2,787 | -0,539 | 0,224 | |
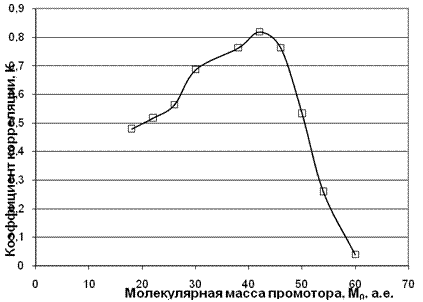
Рис. 3. Зависимость коэффициента корреляции от молекулярной массы промотора.
Вполне резонно предположить, что вероятность обрыва цепи вероятность процесса установления связи между движущимися друг относительно друга молекулами тем выше, чем меньше скорость относительного движения и чем больше время контакта между молекулами ( . Последнее, в первом приближении, можно оценить как частное от деления размеров молекул (L максимальный диаметр) на их относительную скорость движения.
Размеры молекулы рассчитаны с помощью пакета программ ChemiSiteSW. Для протекания реакции, необходимо, чтобы физически реализовались, кроме необходимых условий (насыщение химических связей), еще и достаточные стерические пространственные условия. Активные участки реагирующих молекул должны пространственно совпасть молекула реагента должна не только «догнать» партнера, но еще и «повернуться» к ней активной стороной. Поэтому следует ожидать достаточно четкую корреляцию процесса и от частоты вращения молекул – величины, обратно пропорциональной корню квадратному из момента инерции молекулы (М-0,5Rg1). Действительно, как показал анализ, что таковая наблюдается с коэффициентом корреляции равным 0,862.
Для рассмотренного ряда аминов это не удивительно, но это окажется очень важным обстоятельством при рассмотрении диаминов. Рассмотренные выше корреляции показывают, что наиболее активными аминами проявляют себя амины, обладающие наиболее высокими отрицательными зарядами на атомах азота или, соответственно, положительными на аминном протоне. Поэтому, чтобы выяснить какие водородные связи реально участвуют в процессе, имеет смысл провести корреляцию и с учетом этих зарядов. На рис. 4 показаны результаты проведенной корреляции приращения ОЧ от времени контакта, умноженной на величину заряда на аминном протоне.
Аналогичный анализ был проведен и для заряда на азоте. Здесь также наблюдалась вполне хорошая корреляция с коэффициентом равным 0,918. Сравнение корреляций позволяет сделать вывод о том, что, по-видимому, для этого ряда аминов существенными являются водородные связи, возникающие между протонами амина и атомами кислорода перекисей.
Что касается последовательности расположения добавок в ряду толуидинов (3 , 4, 5 см. табл. 1), то она просто объясняется устойчивостью вращения молекулы вокруг главной оси инерции, что прямо связано с величиной момента инерции молекулы J =2/5 M•Rg2 (момент инерции шара).
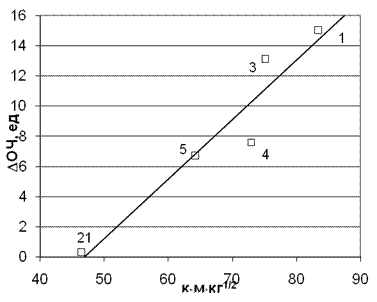
Рис. 4. Корреляция приращения ОЧ от произведения заряда на аминном протоне на время молекулярного контакта для радикала С2Н5ОО• с молекулярной массой М0 =61 (точки на графике соответствуют номерам аминов в табл. 1).
Коэффициент корреляции К = 0,969.
Чем больше момент инерции, тем устойчивее в пространстве движение молекулы. Среди изомеров толуидина по величине радиуса Rg (см. табл. 1) орто изомер (3), в силу своей малой симметрии структуры, движется в пространстве совершенно беспорядочно. Аналогичная ситуация возникает и в ряду ксилидинов (см. рис. 5).
Сравнение корреляций позволяет сделать вывод о том, что, по-видимому, для этого ряда аминов существенными являются водородные связи, возникающие между протонами амина и атомами кислорода перекисей. Топлива группы I (с ОЧИ 86-91) также были проверены на аналогичные корреляции, и для этой довольно большой группы аминов подтвердилась ожидаемая корреляция. Из особенностей изученной группы аминов отметим, во-первых, то, что для топлив с таким высоким значением ОЧ наблюдаются относительно малые значение приращения ОЧ, как это и понятно из предлагаемого механизма. Далее, если для топлив II группы анализировались моноамины, то в данном случае сравнительному анализу подверглись наряду с ними и диамины. Последние естественно более активны, чем моноамины, но и они хорошо укладываются в предлагаемую корреляцию. В данную группу попали амины с довольно широким спектром молекулярных масс и скоростей теплового движения молекул. По отработанной методике, рассмотренной выше, проводилась также серия корреляций приращения ОЧ:
- от молекулярной массы М (с коэффициентом корреляции равным 0,271);
- от скорости теплового движения (от массы М 0,5) с коэффициентом корреляции равным 0,213.
Однако, с переходом к дальнейшим корреляциям, учитывающим:
- относительную скорость движения (с коэффициентом корреляции равным 0,213);
- время контакта (с коэффициентом корреляции равным 0,233);
- произведения времени контакта на заряд аминного протона (рис. 4) (с коэффициентом корреляции равным 0,797);
происходит существенное улучшение корреляции.
Корреляция ухудшается, если перейти к учету заряда на атоме азота. Это обстоятельство снова подтверждает утверждение о том, что главную роль в связывании «вредных» радикалов в предпламенных процессах играют водородные связи, возникающие между протонами амина и кислородными атомами перекисей. Соображения симметрии в ряду ксилидинов определяют их взаимное расположение по эффективности. Здесь ситуация совершенно аналогичная той, что мы имели в случае толуидинов. Действительно, моменты инерции этих изомеров убывают в последовательности убывания их в ряду мета пара орто- (см. табл. 1). Эти свойства симметрии молекул аминов и определяют их расположение по величине приращения ОЧ.
Приведенная корреляция на рис. 4 показывает, что амины с большим зарядом на протоне сравнительно более эффективны. Казалось бы, это правило нарушают диамины, которые успешно конкурируют в этом отношении, хотя и имеют гораздо меньший заряд.
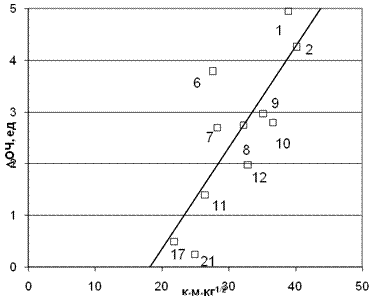
Рис. 5. Корреляция между приращением ОЧ и произведением заряда на аминном протоне на время молекулярного контакта (Мо=48). Коэффициент корреляции 0,818.
(Если писать 42, то надо говорить о сумме Мо1 и Мо2)
Это противоречие легко устраняется, если учесть стерический фактор. Чтобы прореагировать, реагенту необходимо занять соответствующее пространственное положение по отношению к партнеру, т.е. молекуле нужно повернуться. Корреляция, приведенная ниже, как раз и относится к такому случаю. Скорость поворота молекулы или частота ее вращения пропорциональна корню квадратному из ее момента инерции, поэтому для таких симметричных молекул, как диамины, вполне справедливо утверждение, что для вступления в реакцию им достаточно повернуться не на полный оборот, а совершить лишь пол-оборота. Это или увеличивает формально их частоту вращения в 2 раза, что фактически увеличит время контакта в корень из 2 раз, или, наконец, увеличит заряд в корень из 2 раз.
Изложенное обстоятельство и должно объяснить аномальную «рокировку» диаминов, что показано на рис. 6, где корректировка частоты вращения молекул диаминов резко улучшила коэффициент корреляции до значения 0,887. Более того, если из массива аминов исключить несимметричную молекулу ортоксилидина (12), то корреляция резко улучшиться до значения коэффициента корреляции равного 0,95.
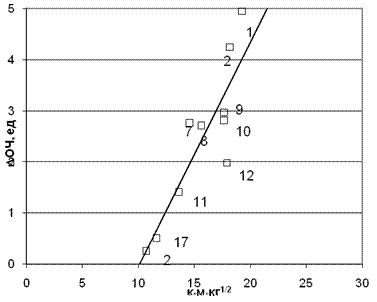
Рис. 6. Корреляция приращение ОЧ от произведения заряда на аминном протоне qH
на время молекулярного контакта при относительном вращении
(Rg1M00,5 Rg1M0,5) (для молекулярной массы M0=34).
Коэффициент корреляции 0,887.
Точки на графике соответствуют номерам аминов в табл. 1.
В этом массиве аминов имеется еще одно примечательное обстоятельство. Этилендиамин при аналогичной корректировке частоты вращения совсем не улучшает корреляцию, поэтому его пришлось оставить без учета бифункциональности его молекулы. Очевидно, мы здесь встречаемся с особым случаем. Из литературы известно, что соединения с двойными связями повышают ОЧ, т.к. способны обрывать цепные процессы и тем самым уменьшать вероятность продолжения и разветвления цепи в предпламенных процессах. Молекула этилендиамина является «ловушкой» для радикалов и перекисей как амин и как носитель π-электронов. В данном случае если симметрия молекулы по аминным группам не проявляет себя, то очевидно такую экзальтацию молекулы амина остается приписать только облаку π-электронов. Более того, можно даже попытаться сделать сравнительную количественную оценку эффективности двойной связи. Действительно, этилендиамин и бутандиамин по своей эффективности попадают в вилку между пара- и орто- ксилидинами. Что касается бутандиамина молекулы только с σ-электронами, то здесь, как мы выяснили, играет роль бифункциональность и симметрия молекулы. Высокую сравнительную эффективность молекулы с облаком π-электронов можно объяснить, если приписать двойной связи эффективный отрицательный электрический заряд равный разности зарядов на атомах азота ксилидинов и этилендиамина(см. табл. 1):
Δq = 0,863 0,538 = 0,325
Весьма вероятно, что здесь мы встречаемся с замечательным явлением синергизма, когда два явления разной природы складываются и дают объединенный эффект. Молекула этилендиамина с одной стороны является «ловушкой» для радикалов и перекисей как амин, с другой наличие двойной связи в молекуле амина само по себе приводит к обрыву цепи. Этим же обстоятельством, наличием сопряженных двойных связей, вероятно, объясняется сравнительно высокая активность ариламинов (анилина и монометиланилина).
Для М0=48 (гидроперикись метана) коэффициент корреляции резко понижается и становится равным 0,483. Таким образом, результаты корреляции показывают, что в нее лучше укладывается допущение, что амины улавливают чистую перекись водорода, а не радикалы гидроперикисей. Сравнение корреляций и для этой группы топлив позволяет сделать вывод о том, что и для этого ряда аминов существенными являются водородные связи возникающие между протонами амина и атомами кислорода перекисей. По данным работы [4] был проведен анализ для топлив с ОЧ 91,5 с добавками следующих аминов: анилин, метиламин, этиламин, изопропиламин и n-бутиламин в концентрации 0,1 моль. Для группы аминов, исследованных с этим топливом, также проводился корреляционный анализ для выявления природы промоторов. Варьировалось значения М0 с шагом равным 4 в пределах от 16 до 68 единиц массы и рассчитывалось значение коэффициента корреляции, что и представлено на рис. 7.
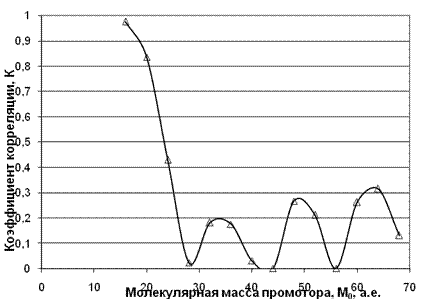
Рис. 7. Зависимость коэффициента корреляции от молекулярной массы промотора.
Анализ коэффициента корреляции в его зависимости от молекулярной массы промотора показывает 4 максимума в районе М0=16, 36, 48, 64. Эти данные позволяют утверждать, что вероятнее всего (коэффициент корреляции равен 0,976) мы имеем дело с атомарным кислородом или радикалом гидроксила. С небольшим статистическим весом в предпламенных процессах могут участвовать также и чистая перекись водорода с высшими перекисными радикалами ROOH.
И в этом случае корреляция для прироста ОЧ от произведения величины заряда на амином протоне на время молекулярного контакта ( имеет коэффициент корреляции 0,885 и оказывается гораздо лучше, чем с зарядом на атоме азота. Сравнение корреляций и для этой группы топлив позволяет сделать вывод о том, что, и для этого ряда аминов существенными являются водородные связи, возникающие между протонами амина и атомами кислорода перекисей. Полученные корреляции (см. рис. 8) позволяют сделать еще один вывод о том, что корреляция для этой группы аминов значительно лучше, если выбрать значения для М0=17 (это соответствует радикалу ОН) коэффициент корреляции =0,885 для протона амина и 0,951 и 0,714 для атома азота. Если взять М0=34, что соответствует перекиси водорода, то коэффициент корреляции резко падает вплоть до полного отсутствия корреляции к=0,042.
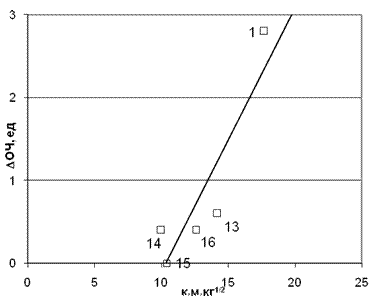
Рис. 8. Корреляция приращения ОЧ от произведения заряда на аминном протоне
на время молекулярного контакта (коэффициент корреляции 0,885 для молекулярной массы M0=34) Точки на графике соответствуют номерам аминов в табл. 1.
Возможность реализации такого же механизма действия добавок к топливам была проверена и для вторичных аминов. Все необходимые свойства аминов сведены в табл. 2. [2-4]. По изложенной выше методике для топлив I группы была получена корреляция, где в качестве добавок были применены соответствующие соединения (табл. 2.).
Корреляция приращения ОЧ от произведения заряда аминного протона на время контакта показала, что в этом случае коэффициенты корреляции значительно хуже и составляет, для М0=34 всего 0,541. Здесь интересно отметить рокировку N-трет-бутилфурфуриламина и пиперидина. Судя по значению заряда на протоне у первого он значительно ниже, но в структуре его молекулы наблюдается следующая особенность: здесь, на расстоянии примерно равном длине молекулы перекиси водорода, находятся рядом два атома – азота и кислорода в кетонной группе. Этот фрагмент молекулы может связать молекулу перекиси сразу двумя водородными связями: первая возникает между протоном перекиси и кетонным кислородом, а вторая между кислородом перекиси и протоном амина. Следовательно, данный амин является бифункциональным.
Амины, приведенные в табл. 2, вводились в топливо в концентрации 0,1 моль. Результаты корреляции проведенной по описанной выше методике показали, что наилучшее значение коэффициента корреляции получается в том случае, если взять перекись водорода с М0=34. Иными словами, и в данной группе амины-«ловушки» связывают охотнее всего перекись водорода.
В заключение отметим, что для N,N-(диметил)трет-бутиламина – (11) с его аномально низким зарядом δq=0,046, нам не удалось в рамках предложенного механизма найти объяснение аномально высокой его эффективности. Особенностью структуры молекулы этого соединения является ее разветвленность. В работе [7] на модельных топливах исследовался процесс предпламенного окисления смеси линейного (н-гептан) и разветвленного (изооктан) углеводородов, и было найдено, что разветвленный углеводород в условиях предламенных температур не подвергается окислению, поскольку имеет более высокую энергию активации окислительного крекинга. На прямом опыте было установлено, что добавление изооктана к н-гептану приводит к пропорциональному снижению температуры смеси топлив, что можно рассматривать как разбавление реакционно-способного н-гептана химически инертным в тех же условиях изооктаном. Таким образом, изооктан в данных условиях выполняет роль ингибитора окислительного предпламенного процесса. В работе [9] также обсуждалось различие н-гептана и изооктана, имеющих полярные значения ОЧ. Здесь химическая пассивность компактных разветвленных молекул изооктана связывается с малым значение сечения столкновения по сравнению с этим же параметром для линейных молекул, для которых сечение столкновения, а значит и предэкспонент в константе скорости химической реакции, значительно больше. Отсюда можно сделать вывод, что разветвленные молекулы практически не участвуют в окислительных предпламенных процессах из-за торможения химических процессов, как по причине высоких энергий активации, так и из-за небольшого значения предэкспоненты в константе скорости химической реакции. Возможно обсуждаемый третичный амин работает по такому же механизму. По механизму образования водородных связей он просто работать не может, т.к. в его молекуле отсутствуют подвижные аминные протоны. Скорей всего влияние на ОЧ N,N-(диметил)трет-бутиламина связано с локальным понижением температуры и, вследствие этого, уменьшением начальной концентрации no радикалов – промоторов (см (3)-(5)).
Таблица 2
Свойства вторичных аминов
№ | Присадка | Мол. масса | Увеличение октанового числа при концентрации присадки 2% об. | DОЧ/моль х 100 | Увеличение ОЧ при концентрации присадки 0,1 моль | Lmax.диаметр | Rgрадиусинерции | dqNзарядазота | dqHзарядводорода | ||||
| I группа топлив | II группа топлив | III группа топлив | I группа топлив | II группа топлив | I группа топлив | ||||||||
| ОЧМ | ОЧИ | ОЧМ | ОЧМ | ОЧИ | ОЧМ | ОЧИ | |||||||
| 1 | N-метиланилин | 107,2 | 6,2 | 4,6 | 18 | 5,79 | 16,8 | 5,3 | 3,8 | 7,319 | 2,040 | -0,662 | 0,317 |
| 2 | N-метилпаратолуидин | 121,2 | - | - | 18 | - | 15 | - | - | 8,178 | 2,290 | -0,662 | 0,317 |
| 3 | N-метилортотолуидин | 121,2 | - | - | 12,4 | - | 10,3 | - | - | 7,075 | 2,047 | -0,348 | 0,317 |
| 4 | пирролидин | 71,1 | - | - | 8 | - | 11,3 | - | - | 4,155 | 1,439 | -0,742 | 0,314 |
| 5 | N,N-диметилаmин | 41,1 | - | - | - | - | - | 6,66 | 2 | 4,213 | 1,223 | -0,357 | 0,206 |
| 6 | N,N-диизопропилаmин | 101,2 | - | - | - | - | - | 1,33 | 0,9 | 6,19 | 1,940 | -0,360 | 0,200 |
| 7 | N,N-дипропилаmин | 101,2 | - | - | - | - | - | 0,44 | 0,3 | 7,697 | 2,316 | -0,360 | 0,200 |
| 8 | NN-диэтиламин | 73,1 | - | - | - | - | - | - | 0,6 | 5,512 | 1,704 | -0,361 | 0,205 |
| 9 | N-третбутилфурфуриламин | 153,4 | 3,2 | - | - | 1,9 | - | - | - | 8,712 | 2,708 | -0,332 | 0,212 |
| 10 | пиперидин | 85,2 | 1,26 | - | 5 | 1,48 | 5,95 | 1,23-1,94 | 0,7-1,11 | 4,974 | 1,630 | -0,742 | 0,314 |
| 11 | NN-диметилтретбутиламин | 101,2 | 1,26 | - | - | 1,24 | - | - | - | 5,625 | 1,826 | -0,204 | 0,046 |
| 12 | N-метилбензиламин | 121,2 | 0,74 | - | - | 0,64 | - | - | - | 8,304 | 2,385 | -0,357 | 0,205 |
| 13 | дибензиламин | 197,3 | 1,0 | - | - | 0,51 | - | - | - | 10,37 | 3,311 | -0358 | 0,205 |
| 14 | диизобутиламин | 129,2 | 1,2 | - | - | 0,85 | - | - | - | 7,589 | 2,603 | -0,362 | 0,204 |
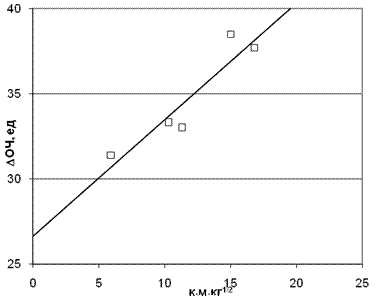
Рис. 9. Корреляция приращения ОЧ от произведения заряда на амином протоне на
время молекулярного контакта. Коэффициент корреляции = 0,951 для М0=34.
Точки на графике соответствуют номерам аминов в табл. 2.
Аналогичные корреляции были проведены для топлив III группы. На рис. 9 показана корреляция приращения ОЧ от произведения заряда на протоне амина на время контакта для молекулярной массы гидроперекиси М0=34. Как видно из рис. 9, предлагаемый механизм неплохо подтверждается и в этом случае.
Выводы
1. Предложен и обоснован механизм действия аминов, в качестве присадок к топливам для двигателей с искровым зажиганием.
2. Предложена методика анализа сравнительной эффективности различных азотосодержащих присадок, работающих по этому механизму.
3. Обнаруженные закономерности и кажущиеся исключения из них находят свое естественное объяснение на основе учета более тонких особенностей структуры и свойств молекул аминов.
4. Проведенный корреляционный анализ позволяет сделать вывод о том, что промоторами вероятнее всего являются перекись водорода и радикал гидроксила, именно для них амины являются «ловушками».
Литература
1. Семенов Н.Н. К теории процессов горения. В кн. Теория горения и взрыва. М: Наука, 1981. С. 16-30.
2. Батрин и др. Нефтепереработка и нефтехимия. 1999, №3.
3. Лернер М.О. Химические регуляторы горения моторных топлив. М: Химия, 1979. 221 с.
4. Lyle D. Burns, Organic antiknock chemicals, 1984, p. 744-748.
5. http://www.ChemSw.com
6. Азатян В.Г., Карташов Ю.И., Румянцев В.Н. III Международная научно-практическая конференции «Новые топлива с присадками»: Сборник трудов. СПб: Академия прикладных исследований, 2004. С. 359-362.
7. Мельников С.Л., Киселев Ю.В., Выхрестюк Н.И. IV Международная научно-практическая конференции «Новые топлива с присадками»: Сборник трудов. СПб: Академия прикладных исследований, 2006. С. 269-283.
8. Колесников И.М., Винокуров В.А., Колесников С.И., Яблонский А.В. «Химия и технология топлива и масел», 2001, №5. С. 23-24.
9. Скобелев В.Н., Хотунцова С.В., Сердюк В.В., Ашкинази Л.А. III Международная научно-практическая конференции «Новые топлива с присадками»: Сборник трудов. СПб: Академия прикладных исследований, 2004. С. 135-142.
C текущей ситуацией и прогнозом развития российского рынка антидетонационных добавок можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Рынок антидетонационных добавок в России
C текущей ситуацией и прогнозом развития российского рынка бензина можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Рынок автомобильных бензинов в России».
В.Н. Скобелев, В.М. Яблоков, СПбГТИ, Санкт-Петербург,
В.В. Сердюк, Л.А. Ашкинази, Академия прикладных исследований, Санкт-Петербург