ПОЛИМЕРНЫЕ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВ
Полимерные системы доставки главным образом используются, чтобы достигнуть или временного или пространственного контроля доставки лекарственного препарата.
1. Введение: контролируемое высвобождение препарата
По существу, полимерные транспортные средства позволяют лекарствам быть переданными в течение расширенного промежутка времени и к локальному участку действия. Они разработаны, чтобы увеличить безопасность препарата и эффективность и улучшить совместимость с организмом пациента. Использование полимеров разработано, чтобы поддержать терапевтические уровни препарата, уменьшить профили побочного эффекта, уменьшить количество молекул препарата и частоту дозировки и облегчить поставку лекарств с коротким временем полужизни in vivo.
Управляемо-высвободительная функция систем доставки препарата дает возможность молекулам лекарства использовать врожденные кинетические свойства, чтобы управляться характеристиками полимерных транспортных средств. Устройства управляемого выпуска позволяют потенциальным лекарствам с короткими временами полужизнями управляться минимальными колебаниями за расширенный промежуток времени и с потенциально более низким уровнем токсичности. В конечном счете, формы дозировки лекарств длительного действия улучшаются терапевтически, что гарантируется однородной плазменной концентрацией препарата в твердом состоянии. Идеально, устройство доставки должно предложить медленное (первого порядка или нулевого порядка) поглощение препарата органами желудочно-кишечного тракта. Если сравнить профили уровня препарата в крови форм с замедленным высвобождением дозировки с контролем обычных и управляемых форм дозировки, то получаем профили как на рисунке 2.1. Обычная таблетка или капсула обеспечивает единичный и кратковременный прорыв препарата. Более того, фармакологический ответ только наблюдается, если количество лекарства приближается к минимальной эффективной концентрации. Формы с замедленным высвобождением восстанавливают эффект взрыва, но плазменные концентрации не управляются так же долго как системы с замедленным высвобождением и постепенно начинают исчерпываться. Системы с управляемым выпуском, напротив, восстанавливают флуктуации в плазменных уровнях лекарства, замедляя поглотительную норму, относящуюся к замедлению высвобождения лекарства, в результате вызывая эффективный фармакологический ответ.
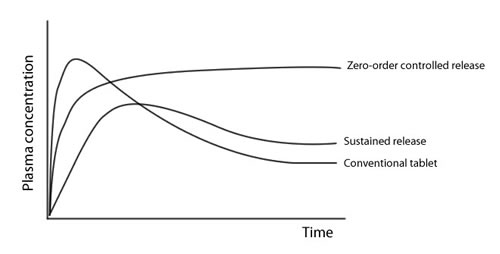
Иллюстрация 1.: Концентрации плазмы лекарств для обычного препарата, препарата с замедленным высвобождением и нулевого порядка препарата с замедленным высвобождением.
Понимание особенностей лекарственных препаратов и полимеров является существенным для успеха устройства доставки препарата. Изменяя свойства полимера, нормой выпуска лекарственного препарата можно также управлять. Кроме того, окружающая среда, в которой устройство доставки должно функционировать, также воздействует на выбор полимера, препарата и проекта устройства. Поэтому многогранный подход является наиболее успешным для доставки препарата с помощью полимерных систем.
1.1 Стандартные пленки
Обычные формы дозировки препарата типично распределены через растворимые наполнители. Препарат быстро освобождается от его формы дозировки и быстро достигает высокой концентрации. При этом управляют его падениями концентрации по экспоненте до следующей дозы. Следовательно, существует волнообразный образец концентрации препарата в плазме и тканях, и оптимальный терапевтический уровень только кратко присутствует. Обычные формы дозировки, в отличие от систем управляемого выпуска, не управляют нормой выпуска.
Обычное пленочное покрытие используется, чтобы улучшить появление продукта, чтобы улучшить обработку и предотвратить чистку. Кроме того, пленочное покрытие используется, чтобы замаскировать неприятный вкус и аромат и улучшить стабильность продукта. Однако, покрытия типично не применяются, чтобы изменить особенности выпуска препарата. Это может часто заставлять обычные формы дозировки показывать колеблющиеся уровни препарата, недостаточное влияние на механизм болезни и неудобных режимов дозирования.
Как правило, производные целлюлозы выбираются, чтобы действовать как покрытие с наиболее общим полимером, которым является гидроксипропил метилцеллюлоза (ГПМЦ). Полимер ГПМЦ обеспечивает образование водорастворимых покрытий, которые могут также быть окрашены различными пигментами. Он также предоставляет легкую обработку из-за своей нелипкой структуры. Полимер ГПМЦ имеет очень высокий предел прочности и очень низкий коэффициент растяжения. Следовательно, прежде чем полимерная пленка сломается, к ней необходимо приложить очень большую силу, но произойдёт лишь очень незначительное удлинение покрытия, прежде чем произойдёт разрыв. Это может вызвать проблемы, если необходимо покрытие для сложного ядра таблетки, таких как витамины и монограммные препараты.
Чтобы изменить особенности полимера, добавляют пластификаторы, чтобы улучшить гибкость. Полимер ГПМЦ также может также быть смешан с гидроксипропилцеллюлозой, у которой есть более низкий предел прочности и намного более высокое значение коэффициента удлинения. Смесь этих двух сортов может устранить соединение, наблюдаемое в монограммных препаратах, улучшить связь покрытия с основанием препарата, а также уменьшить уровень ломкости на краях таблетки. Обычное покрытие, однако, не будет управлять нормой выпуска препарата от ядра.
1.2 Функциональные полимеры
Функциональные полимеры разработаны, чтобы изменить фармацевтическую функцию форм дозировки и управлять выпуском активных компонентов. Большинство форм дозировки управляемого выпуска могут быть категоризированы как матрица, резервуар или осмотическая система. В матричных системах препарат вложен в матрицу полимера, и выпуск имеет место, отделяя препарата в матрице и выпуск в нужную среду. Это может быть характеризовано как массовое транспортное явление. Напротив, системы типа резервуаров имеют ядро препарата, окруженное управляющей нормой мембраной, такая же, как брюшинная, покрывающая продукты и осуществляющая внедрение. Факторы, такие как pH фактор и присутствие пищи затрагивают норму выпуска препарата при использовании устройств типа бассейна. Увеличение гидростатического давления ведет осмотические устройства, принуждая суспензию или раствор препарата к выходу из устройства через маленький порт доставки. Выпуск препарата независим от pH фактора и возможно смодулировать особенности выпуска, оптимизируя свойства покрытия полимера и препарата.
2. Механизмы действия контролируемого высвобождения препарата
Самый важный признак устройства управляемого выпуска - способность поддержать постоянную норму доставки препарата. Продолжительность должна также быть совместимой с физиологическими ограничениями и контролируемым маршрутом. Также были развиты многочисленные устройства доставки, которые функционируют через различные механизмы действия, чтобы достигнуть желательной нормы высвобождения препарата. Существует три общих механизма действия, а именно диффузия, осмотические эффекты и эрозия, которые обрисованы в общих чертах ниже.
2.1 Диффузия
Полимерные пленки, которые используют диффузионный механизм, разрешающий проникновение водных растворов из желудочно-кишечного тракта (ЖКТ) в ядро таблетки. В результате происходит растворение препарата, которое сопровождается диффузией через полимерную мембрану в организм человека. Оценка диффузии препарата может быть определена физико-химическими свойствами лекарственного препарата и самой мембраной. Свойства полимерной мембраны могут изменяться в зависимости от выбора полимера, молекулярной массы полимера и включений пластификаторов. Все эти факторы могут изменить структуру пленки, и лекарство может диффундировать через сеть пор и каналов внутри мембраны, таким образом, значительно облегчая процесс высвобождения.
Если выбранная полимерная мембрана гидрофильна, то норма поглощения жидкости очень высока и дозировка возрастает. Следовательно, с увеличением формы дозировки увеличивается и связанный с ним показатель диффузивности, который увеличивает норму высвобождения препарата. Наоборот, если полимер гидрофобен, и норма поглощения незначительна, распространение препарата из полимерного матрикса происходит намного медленнее.
Управляемые распространением устройства имеют тенденцию разделяться на два главных типа: монолитные устройства и устройства типа резервуар. Монолитные устройства состоят из активного фармацевтического компонента (АФК), сильно смешанного с управляющим нормой полимером или через дисперсию в полимере или через растворение АФК в полимере. Хотя высвобождение АФК из монолитного устройства типично не происходит в соответствии с кинетикой нулевого порядка, это - один из самых простых и самых удобных методов получения длительного высвобождения. Пример этого механизма используется в случае с трансдермальными терапевтическими системами (ТТС). ТТС поставляет препарат систематически в циркуляторную систему пациента через кожу. Нормой доставки препарата управляет градиент распространения между системой и кожей. Препарат однородно распределяется внутри полимерного матрикса и начинает проникать через кожу, как только ТТС помещается на поверхность кожи. Так фентанил доставляют пациентам посредством ТТС, чтобы уменьшить боль при раковых заболеваниях.
Добавочное использование механизма распространения препаратов заключается в устройствах типа резервуар. Резервуары состоят из АФК, содержащегося в ядре, которое окружено управляющей нормой мембраной. Транспорт АФК, проведенного в ядре, через окружающую пленку полимера, происходит путем растворения поверхности пленки. Свойства граничной пленки могут использоваться, чтобы изменить механизм высвобождения. В определенных условиях желательно использовать плотную мембрану с микропоральной гидрофобной структурой. Поры соединяют две стороны мембраны и позволяют АФК распространяться в жидких капсулах через пористые каналы. Однако, если у АФК будет низко водная растворимость, то ¬распространение будет замедлено и может даже полностью остановиться. Наоборот, если используется мембрана с известной проницаемостью, а также достигнуты условия бесконечного потока, то шкала активного высвобождения будет постоянной, и могут быть достигнуты условия кинетики нулевого порядка. Примером успешной системы доставки типа резервуар может служить Alza Progestasert®, которая содержит стероидный прогестерон в ядре, окруженном этилено-виниловым ацетатным сополимером. Это успешно поддерживает относительно постоянную шкалу высвобождения прогестерона на протяжении ряда лет. Недостаток систем типа резервуар заключается в их склонности к демпингу доз. Демпинг доз – это явление, при котором относительно большое количество АФК быстро высвобождается, делая уровень содержания лекарства в системах циркуляции в организме потенциально опасным. Разрывающие эффекты могут случаться, когда АФК насыщают мембрану, окружающую ядро во время хранения. Как только устройство помещено в водную среду, активный компонент ¬быстро отделится от мембраны, вызывая разрывающий эффект и быстрый демпинг дозы. Величина «взрыва» определена коэффициентом распространения активного агента в мембране, толщиной мембраны и длительностью времени хранения.
2.2 Осмотические эффекты
Осмотические системы доставки препарата типично подходят для перорального использования, состоят из сжатого ядра таблетки, которое покрыто полуводопроницаемым мембранным покрытием. Большинство осмотических устройств использует относительно водопроницаемые материалы, такие как полимеры целлюлозы, особенно ацетат целлюлозы (АЦ). Целлюлозные мембраны вообще показывают водный диапазон проходимости между 1 x 105 и 1 x 107 см3 [cm/cm2 h atm]. Проницаемость АЦ-пленок может быть искусственно отрегулирована, варьируя степень ацетилирования: с увеличением содержания ацетила уменьшается проницаемость. Этилцеллюлоза также широко используется как мембрана для пероральных осмотических систем. Водная проницаемость чистой этилцеллюлозы низка, но увеличена объединением с растворимыми в воде добавками, такими как ГПМЦ.
При погружении в водной среде гидростатическое давление в таблетке будет расти из-за селективного входа воды через полуводопроницаемую мембрану. Чтобы гарантировать, что покрытие в состоянии сопротивляться давлению в пределах устройства доставки, толщина мембраны обычно колеблется между 200 и 300 мкм. Мембрана нерасширяема, и увеличение объема, вызванное впитыванием воды, поднимает гидростатическое давление. Растворение препарата происходит в изоляции от окружающей среды ЖКТ. Давление уменьшено интенсивным потоком раствора из устройства доставки через маленькое отверстие.
Когда внутреннее осмотическое давление повысилось достаточно, то раствор или суспензия лекарственного препарата удаляется согласно предопределенной норме через отверстие доставки, процесс продолжается, пока весь твердый препарат не удаляется, и остается заполненная раствором оболочка. Первоначально 60-80 % препарата высвобождается при шкале нулевого порядка. Остаточный растворенный препарат продолжает доставляться, но по исчерпанной норме, пока осмотические давления внутри и снаружи таблетки не равны между собой.
Стимул, чтобы вовлечь воду в устройство доставки является различие между осмотическими давлениями внешней окружающей среды и раствора препарата. Осмотическое давление раствора лекарственного препарата должно быть относительно высоко, чтобы преодолеть осмотическое давление клеток тела. Следовательно, система часто содержит дополнительные осмотически активные материалы, такие как сахар или соли в пределах ядра, поскольку АФК может не всегда быть растворимым в воде вплоть до того, чтобы быть способным проявить адекватное осмотическое давление, чтобы запустить механизм устройства высвобождения. В состав лекарственного средства могут также входить солюбилизаторы, которые делают растворимым препарат, поддерживая pH микроокружения, что помогает при высвобождении и поглощении препарата. Осмотические системы доставки препарата осуществляют высвобождение препарата по норме, которая зависит pH фактора и гидродинамики внешней среды-растворителя. Система также применима для доставки лекарственных препаратов с широким диапазоном водной растворимости¬. Следовательно, препарат может или быть высвобожден как раствор или как суспензия. Однако если препарат высвобожден как суспензия, то он должен быть растворим in vivo, прежде чем он станет систематически доступным.
2.3 Эрозия полимера
Разлагаемые микроорганизмами полимеры используются, чтобы уменьшить потребность в дополнительном хирургическом вмешательстве, требуемом удалить биологически неразлагаемые матриксы носители. Биологический распад определяет процесс расщепления цепи полимера, который приводит к потере молекулярной массы. Деградации вызывает последующую эрозию материала, которая определена потерей массы. Для полимеров биологический распад происходит с помощью двух главных механизмов: поверхностная или массовая эрозия. Поверхностная или гетерогенная эрозия происходит, когда норма эрозии превышает норму водного проникновения в толщу полимера. Массовая или гомогенная эрозия происходит, когда молекулы воды проникают внутрь полимера гораздо быстрее, чем происходит эрозия.
Высвобождение лекарственного препарата из разлагаемых микроорганизмами полимеров может произойти путем трех основных механизмов. Первый механизм влечет за собой активацию агента ковалентно связанного с ядром полимера, часто называемого подвесной цепной системой. Поскольку основа раскалывается, то происходит сопутствующее этому высвобождение АФК в контролируемой норме. Второй механизм происходит, когда АФК содержится в ядре, окруженном раковиной из материала, способного к биодеградации. Норма деградации полимерной раковины управляет нормой высвобождения препарата, и так как полимерная раковина, в конечном счете, разрушается полностью, то хирургическое удаление устройства доставки является ненужным. В заключительном механизме лекарство гомогенным образом ресуспендировано в полимере, и высвобождение препарата контролируется диффузией, комбинацией диффузии и эрозии или только эрозией.
Многочисленные биоразлагаемые полимеры были синтезированы, чтобы доставлять лекарства, клетки и ферменты. Свойства этих полимеров могут быть изменены включением множества неустойчивых групп таких, как сложноэфирные, ангидридные и уретановые, в их ядро. Полимеры на основе полиэстера – одни из самых широко распространенных и используемых систем, частично поли- молочная кислота (ПМК), поли- гликолевая кислота (ПГК) и их сополимер поли- молочная-когликолевая кислота (ПМГК). Кинетика биодеградации может быть изменена путем настройки пропорции ПМК и ПГК в сополимере и изменением молекулярного веса полимера. Для микросфер ПМГК низкая молекулярная масса и высокое содержание гликолевой кислоты приводят к быстрому высвобождению. Однако ПМГК страдает от возрастания локальной активности во время деградации, которая может вызывать болезненную чувствительность и причинять ущерб стабильности белковых лекарств.
Пероральная норма дозы формируется в зависимости от деградации полимерного матрикса, а также зависят от времени транзита формы дозы через ЖКТ. После приема пищи желудок приходит в состояние переваривания пищи, в котором жидкости и перевариваемый материал быстро опустошаются. По существу, желудочное время жизни медленного разрушения формы дозировки может очень сильно изменяться в зависимости от состояния желудка, пустого или наполненного пищевым материалом, и формы дозировки способной к деградации в большей или меньшей степени. Кроме того, изменение pH фактора желудка сильно зависит от степени его заполненности, и это может также влиять на норму деградации полимерного матрикса.
3. Примеры систем доставки управляемого высвобождения
3.1 Модифицированное высвобождение
Множество форм дозировки используют концепцию модифицированного/измененного высвобождения; высвобождение кинетики препарата управляется свойствами полимерного матрикса, содержащего в себе АФК. Как правило, активный компонент дисперсно рассеян в форме отдельных частиц всюду в матриксе полимера, который является или гидрофильной или липофильной по своей природе. Этот принцип используется для противозачаточных вагинальных колец. Кольцо эластомера силикона, разработанное таким образом, чтобы размещаться вокруг шейки матки, содержит дисперсию противозачаточного стероида медроксипрогестерон ацетат. Стероид медленно выпускается через диффузный механизм, достигая устойчивого уровня плазменного прогестина, и способствует удлинению периода контрацепции.
Мембранные контролируемые устройства распространения также обычно используются в фармацевтических препаратах. Мембрана действует как межфаза, которая отделяет две фазы и ограничивает транспорт составляющих между этими фазами. Простейшее устройство синтетической мембраны полимера представляет собой, например полиэтиленовая пленка, где проводимость осуществляется простой диффузией. Более сложные системы подразумевают использование микропоральных систем, в которых проникающий материал должен распространяться через заполненные жидкостью поры в пределах мембраны. Если мембрана будет разлагаема микроорганизмами, то высвобождение препарата будет зависеть от нормы распространения препарата через мембрану и нормы разложения мембраны.
Гидрогели - дальнейший пример измененных устройств высвобождения. Гидрогели – поперечно-связанная сеть гидрофильньных полимеров, у которых есть способность поглощать большое количество воды и разбухать, поддерживая свою трехмерную структуру. Типичная мембрана гидрогеля обычно состоит или из твердого ядра целевого препарата, или из поперечно-связанного матрикса гидрогеля, содержащего растворенный или дисперсно-рассеянный препарат в окружении управляющей нормой высвобождения мембраны. Гидрогелями бывают гладкими в обезвоженном состоянии; однако, при входе в контакт с водной средой, окружающая вода проникает в свободные места на поверхности между макромолекулярными цепями.
Когда достаточное количество воды вошло в матрикс, градус температуры перехода, Tg полимера спадает до температуры окружения. Присутствие воды вызывает развитие стрессов, к которым приспосабливаются увеличением радиуса циркуляции и непрерывного расстояния молекул полимера. Макроскопически это можно классифицировать как опухоль. Поскольку опухоль образуется, то происходит сопутствующее увеличение разложения ядра, и препарат высвобождается через раздутые гибкие области.
В дополнение к механизму управляемого высвобождения, который охарактеризован свойствами матрикса и высвобождаемого препарата, были также разработаны системы, которыми можно управлять дистанционно с помощью таких механизмов, как ультразвук, контроль над ионным обменом и манипулирование магнитными полями. Это желательно, поскольку высвобождение лекарственного препарата опосредовано фактором, который не изменяется со временем и независим от фармакологического эффекта устройства доставки. Следовательно, получение устройства высвобождения нулевого порядка кинетики должно быть достижимым. Однако, они менее распространены и в основном находятся на стадии разработки.
3.2 Покрытые брюшиной продукты
Покрытые брюшиной продукты разработаны, чтобы остаться неповрежденными в желудке и затем высвобождать АФК в отделах тонкого кишечника; также они обозначают формы дозировки отсроченного высвобождения. Целесообразность использования покрытых брюшиной продуктов в том, чтобы препятствовать повреждению АФК, вызываемому желудочными ферментами или кислотностью желудочной жидкости, чтобы уменьшать уровень тошноты, вызванной раздражением желудочной слизистой оболочки, доставить лекарственный препарат к локальному участку действия в слизистой оболочке в максимально возможной концентрации и обеспечить отсроченное высвобождение препарата.
Так как лекарства должны быть в растворимой форме для того, чтобы они смогли быть поглощены, то у компонентов с очень низкой водной растворимостью часто возникают проблемы в случае перорального попадания в организм, связанные с ограниченным временем транзита нерастворенных частиц препарата и его ограниченной растворимостью на участке поглощения. Следовательно, система доставки препарата должна обеспечивать сохранение препарата в желудке и его постепенное высвобождение в двенадцатиперстную кишку и в тонкий кишечник.
Полимеры, которые обычно используются, чтобы достигнуть отсроченного высвобождения, являются анионными полиметакрулатами, такими как Eudragit®, полимеры на основе целлюлозе или поли- (виниловый ацетатный фталат) (ПВАФ). Профиль высвобождения облегчен растворимостью кислых функциональных полимерных групп, зависимой от pH фактора. Например, водная акриловая дисперсия Eudragit® L30-D55, анионный сополимер, основанный на метакриловой кислоте и этиловом акрилате, со свободными группами карбоксила в отношении 1:1 с эфирной группой. Карбоксильные группы только начинают ионизироваться в водных средах при pH факторе 5.5 и выше, обеспечивая устойчивость полимера в кислых средах, но растворимость его в кишечной жидкости.
Норма высвобождения препарата из покрытых брюшиной продуктов имеет тенденцию управляться в соответствии с особенностями полимера и механизмом его высвобождения. Препарат может быть высвобожден через трещины или разломы в матриксе, транспортом через среду, заполняемую поры в покрытии, транспортом через раздутую пленку или транспортом из-за проходимости АФК через непористое покрытие. Поэтому желательная норма высвобождения может быть достигнута, играя на физико-химических особенностях полимера.
3.3 Микросферы
Микросферы вовлекают в матрицу полимера заключенный в капсулу препарат, который высвобождается по относительно медленной норме за длительный период времени. Следовательно, по сравнению с обычными формами дозировки, микросферы предоставляют менее частую форму контролируемого препарата; поэтому часто отмечается увеличение терпеливого согласия. Кроме того, полимерный матрикс обеспечивает защиту АФК и позволяет молекулам, которыми было трудно управлять ранее, такие как нуклеиновые кислоты, быть доставленными к локальному участку действия в высоких концентрациях. Кроме того, так как лекарственный препарат погружен в микросфере, то АФК сохранен отдельно от других микросфер. Следовательно, многократной дозой действия лекарства можно управлять за одну-единственную инъекцию, которая вследствие проблем совместимости, иначе могла бы быть невозможна. Микросферы могут глотаться или вводиться инъекционно, и они имеют много преимуществ перед обычным пероральным употреблением препарата. Препарат заключен в капсулу или в медленно растворимую матрицу, или в управляемую распространением матрицу, которая позволяет препарату проникнуть через поры, сформированные во время уплотнения сферы. Норма высвобождения препарата может управляться через выбор матрикса полимера и связанных с ним химических и физических свойств. Блокирование сополимеров с переменным числом гидрофильньных областей может управлять нормой высвобождения препарата. Чем больше число гидрофильньных областей, тем быстрее осуществляется вход растворителя и тем более быстрой является норма высвобождения препарата.
Однако сополимеризация может также привести к начальному взрыву, во время которого существенная фракция (обычно между 5 % и 50 %) инкапсулированного компонента будет высвобождена. Это нежелательно, поскольку препарат не сможет осуществлять процесс длительного высвобождения, к тому же такой взрыв может привести к токсичности.
В дальнейший первичный детерминант нормы высвобождения препарата - размер частиц. Большие сферы имеют тенденцию высвобождать заключенные в капсулу компоненты более медленно, дольше, чем меньшие по размеру микросферы. В предыдущем исследовании препаратов родамина и пироксикама, начальная норма высвобождения, как выяснили, уменьшается с увеличением диаметра сферы, Это было приписано уменьшению в отношении "поверхностная область к объему" с увеличивающимся размером частицы. Это позволяет желательному профилю высвобождения быть достигнутым относительно легко манипуляцией процесса вбрызгивания. Способность сделать устройство доставки препарата с необходимой нормой высвобождения может также быть достигнута, смешивая микросферы различных свойств. Например, Равиварапу и др. смешивали микросферы, изготовленные из ПМГК низкой молекулярной массы с микросферами, состоящими из форм высокой молекулярной массы. Полимер низкой молекулярной массы привел к образованию пористых микросфер, которые высвободили препарат быстро. Однако микросферы высокой молекулярной массы были плотны и произвели более медленный сигмоидальный профиль высвобождения. Комбинируя эти две формации, норма высвобождения могла быть смоделирована, и она была комбинацией норм высвобождения этих двух формаций. Однако микроинкапсуляция может привести к понижению биологической активности препарата и, следовательно, должен быть произведен тщательный контроль полимерных покрытий. Если слой полимера является слишком толстым, препарат не способен пересечь границу и не будет становиться доступным для организма. Следовательно, препарат не будет поглощен и не выполнит необходимую функцию.
Микросферические формы дозировки будут часто уменьшать колебания в уровнях в крови, но, при сравнении с нативным препаратом, могут иметь более низкие пиковые плазменные уровни препарата. В исследовании, котором сравнивали обычный аспирин с микроинкапсулированным аспирином, обычный аспирин был более быстро доступен и показал почти двойные пиковые плазменные уровни по сравнению с длительным высвобождением микроинкапсулированной субстанции. Однако аспирин поддерживал на более высоком уровне таблетки длительного высвобождения, и в терминах бионакопления обе формы дозировки были эквивалентны. Также, микроинкапсулированная форма дозировки потребовала бы менее частого контроля, и устойчивый профиль высвобождения может привести к уменьшению уровня токсичности и отрицательных воздействий от препарата.
Есть ряд успешных примеров использования микросфер. Таблетки аспирина были сформулированы с микроинкапсулированной ацетилсалициловой кислотой, обеспечивая длительное высвобождение АФК и гораздо лучшее усвоение ЖКТ, чем обычные таблетки аспирина. Горький привкус от АФК может также быть успешно замаскирован, используя процесс микроинкапсуляции, и это было достигнуто для препарата Tylenol®. Кроме того, большая толерабельность формы дозировки может быть достигнута, когда микросферы объединены между собой. Например, микроинкапсулированная ацетилсалициловая кислота, включенная в ректальную свечу, намного снизила уровень раздражения слизистой оболочки прямой кишки, который появлялся от обычной свечи.
3.4 Системы внедрения
За последние годы новые системы доставки такие, как имплантанты, заметно воздействовали на лечение раковых заболеваний. Много средств для лечения рака имеют короткий период полужизни in vivo, и полимерные системы доставки предоставляют подходящую защиту, чтобы дать возможность лекарствам быть доставленными согласно контролируемой норме и продолжительности. Лекарства от рака могут также вызвать токсичность; поэтому способность доставить их в локальном масштабе, а не систематически может улучшить и безопасность, и эффективность химиотерапии рака. Поиангидридные диски такие, как полиангидрид 20:80 поли [(l, 3, бис-п-карбоксифеноксипропан) – ко -(себациновый ангидрид)] использовались, чтобы доставить химиотерапевтические лекарства такие, как кармустин в локальном масштабе, чтобы лечить рак мозга. Диск помещается на поверхность участка резекции опухоли, и препарат медленно высвобождается в течение приблизительно 3 недель, разрушая остающуюся опухоль. Отношение сомономеров может также быть различно, чтобы произвести профили эрозии, которые колеблются от нескольких дней до нескольких лет, что делает препарат выгодным для использования.
Другое использование имплантов – это контролируемое высвобождение противозачаточных стероидов. Твердый препарат в микронной форме гомогенно рассеян в матриксе полимера, сделанном из разлагаемого микроорганизмами или способного к биоэрозии полимера. Полимер формирует шарообразную форму или имплант в формы бусин. Управляемое высвобождение вложенных частиц препарата осуществляется возможной комбинацией эрозии полимера через гидролиз и распространением через разрушенный полимерный матрикс. Норма высвобождения препарата определена нормой гидролиза полимера, молекулярной массой и загружаемым препаратом. Противозачаточные стероиды, такие как левоногестрел, вложены в разлагаемый микроорганизмами ПОЭ и, поскольку полимер гидролизуется, стероид выпускается в циркулирующую систему.
Ограничение, которое часто случается при использовании агентов внедрения – это воспалительный ответ на внедрение импланта. Чтобы минимизировать это, имплант должен иметь минимальную площадь поверхности в соответствии с проектом и очень гладкий поверхностный конец. Кроме того,¬ у импланта должна быть структура, похожая на структуру ткани, в которую он внедряется. Дальнейший фактор у имплантов, также заслуживающий рассмотрения - это потери в механических свойствах, которые последуют при разрушении полимера. Поскольку происходит расщепление цепи, предел прочности внедрения уменьшится, и целостность внедрения может быть поставлена под угрозу. Следовательно, процесс внедрения импланта, может быть не выполнен оптимально. Недавнее продвижение в области имплантов, вводимых in situ, позволило установить ряд полутвердых лекарств. Эти лекарства обычно делаются из полимеров способных к биодеградации, которые могут быть введены через шприц в тело, а после введения сформировать полутвердую структуру. У них есть много преимуществ, особенно при лечении рака. Полимерные импланты, нагруженные препаратом Taxol®, использовались, чтобы лечить участки резекции опухоли мозга у крыс. Однако чтобы обойти потребность в агрессивных процедурах, была исследована термопластичная триблочная полимерная система внедрения. Эта система высвобождала Taxol® дольше, чем за 60 дней и уменьшала побочные эффекты из-за локальной доставки. Есть врожденные неудобства с предложенной системой инъекции, как бы то ни было. Полимер обязан быть в расплавленном состоянии во время инъекции, и это может быть очень болезненным для пациента во время процедуры. Кроме того, высвобождение препарата часто происходит медленнее, чем это было бы идеально и, следовательно, этот метод лечения все еще находится на стадии разработки.
4. Часто используемые полимеры для систем доставки препарата
Большое количество полимеров используется в системах доставки препарата, чтобы приспособить обширное множество конструкций, взаимодействий препаратов и профилей высвобождения, которые требуются. Всё обсуждаемое в данном разделе ни в коем случае не есть окончательный список применяемых в этой области полимеров, но может служить справочником по некоторым из более обычно используемых полимеров и объяснения причин их использования.
Синтетические полимеры обычно используются в системах доставки препарата из-за прекрасного контроля над их врожденными свойствами, который возможен. Эфирные сополимеры метакрулата часто используются, поскольку они нерастворимые по всему физиологическому диапазону pH фактора. Однако они в состоянии раздуться и стать проницаемыми для воды и растворенных веществ; таким образом, они часто используются в измененных системах высвобождения, которые основаны на принципе диффузии. В качестве дополнения к гидрофильным материалам таким, как растворимые эфиры целлюлозы могут выступать более сильно растворимые полимеры и, следовательно, профилем высвобождения препарата можно управлять.
Ацетатный фталат целлюлозы (АФЦ) является одним из наиболее широко используемых синтетических полимеров, который применяется в покрытых брюшиной продуктах. Полимер состоит из свободной гидроксильной группы, внесенной каждой единицей глюкозы цепи целлюлозы; приблизительно половина из них является ацетилированной, еще четверть подвергнута этерификации с одной из двух карбоксильных групп половины фталата. Вторая карбоксильная кислотная группа может вступать в реакции и формировать соли и сохранять основные свойства благодаря своему эфирному характеру. Карбоксильная группа только ионизируется в водной окружающей среде с pH фактором выше 5.5. Это придает АФЦ стойкость к кислым средам, например, таким физиологическим средам, как в желудке, но он растворим в желудочной жидкости. Вещество ПВАП приготовлено путем этерификации частично гидролизованного поли- (винилового ацетата) с фталевым ангидридом. Это обычно используется как покрывающее вещество для твердых компонентов пероральной формы дозировки и доступно коммерчески как водный раствор препарата (запатентованный) для распылителя на основе воды. В зависимости от применения распылителя, спецификация часто базируется на вязкости полимера, поскольку это может воздействовать на поверхностное покрытие. Характеристики могут также управляться содержанием фталила, которое обычно колеблется между 60 % и 70 % и, как было выяснено, затрагивается также pH фактором, при котором распадаются таблетки, покрытые ПВАП.
Осмотические устройства требуют полуводопроницаемой мембраны полимера, то есть такого полимер, который является водопроницаемым, но непроницаем для компонентов раствора. Обычно используется ацетат целлюлозы (АЦ). АЦ покрытия являются нерастворимыми и при этом полуводопроницаемы. Степень проницаемости может быть изменена, варьируя процесс ацетилирования. С увеличением содержания ацетила происходит сопутствующее уменьшение проницаемости. Кроме того, проницаемость АЦ может быть улучшена инкорпорацией текучих усиливающих агентов или пластификаторов. Добавление гидрофильного пластификатора (PEG-200), как было выяснено, увеличивает высвобождение нифедипина от осмотического насоса.
Синтетические деградабельные полиэстеры обычно используются при доставке препарата, и самые общие получены из трех мономеров: лактид, гликолид и капролактон. Норма деградации колеблется от нескольких дней до нескольких лет и определяется кристалличностью, молекулярной массой и гидрофобностью мономера. Поэтому, изменяя эти физические свойства, можно изменять степень доступа воды к эфирным группам и, следовательно, управлять нормой деградации. Кислые побочные продукты деградации полиэстеров вовлекаются во многие биохимические реакции в тканях и, следовательно, многие другие биоразлагаемые полимеры были исследованы. Полиангидриды часто используются в системах доставки препарата, поскольку они биоразлагаемы и обладают биологической совместимостью. В качестве полиангидридов обычно выступают гидриды алифатических и ароматических дикарбоновых кислот, гидрофобные области которых отделены относительно гидрофильньных кислотными ангидридными связями. Ангидриды гидролизуются при физиологических условиях, которые приводит к деградации полимеров. Однако, вследствие наличия гидрофобных областей, деградация ограничена на поверхности, поскольку вода не может проникнуть через большую часть полимера. Это приводит к лучшему процессу эрозии, который можно контролировать, и, впоследствии, часто более поддерживается высвобождение препарата.
Полиортоэфиры были также исследованы как устройства доставки, которыми управляют. Преимущество устройств ПОЭ состоит в том, что ортоэфирные связи лабильны к кислотам, и следовательно, норма деградации устройства может быть смодулирована pH фактором. Понижая pH фактор, темп гидролиза ускоряется, тогда, как увеличение pH фактора понижает норму гидролиза. Поэтому время деградации ПОЭ может измениться от нескольких дней до нескольких месяцев. Однако, ПОЭ являются гидрофобными, поэтому количество воды, доступной, чтобы реагировать с гидролитически неустойчивыми ортоэфирными связями. Следовательно, при физиологических условиях, такой полимер очень устойчив.
Естественные природные полимеры также использовались в системах доставки препарата, поскольку они обладают превосходной биологической совместимостью; однако, естественно полученные полимеры часто страдают от межгрупповой изменчивости. Гидроксипропилцеллюлоза - неионогенный растворимый в воде эфир целлюлозы. Молекулярная замена в гидроксипропилцеллюлозе установлена: однако, молекулярная масса варьируется за счет степени полимеризации основы целлюлозы. С увеличением степени полимеризации, увеличивается и вязкость полимера. Это изменение позволяет гидроксипропилцеллюлозе использоваться для различного диапазона целей, включающего использование как переплет, как матрикс для длительного высвобождения и также как пленочное покрытие.
Гидроксиэтилцеллюлоза - также неионогенный растворимый в воде полимер, полученный из целлюлозы, которая может быть доведена до желатемой вязкости, молекулярные замены и степень замены. Гидроксиэтилцеллюлоза используется как агент утолщения, как биоадгезивный материал и как агент пленочного покрытия. Гидроксипропил метилцеллюлоза (ГПМЦ) частично O-метилированная и O -(2-гидроксипропилированная) - целлюлоза, которая доступна с различными диапазонами вязкости. Сорта высокой вязкости могут использоваться, чтобы задержать высвобождение растворимых в воде лекарств от матрикса, тогда как ГПМЦ низкой вязкости может увеличить высвобождение препарата.
Полимер ГПМЦ широко используется в фармацевтических препаратах как покрытие поверхности таблеток, пленочное покрытие и матрикс управляемого высвобождения препарата. Действуя, как матрикс управляемого высвобождения, ГПМЦ создает острый градиент концентрации на вводно-полимерной поверхности. Это приводит к насыщению матрикса водой. Вода действует как пластификатор и уменьшает Ts полимера ГПМЦ. Следовательно, цепи полимера становятся более гибкими, и полимер начинает раздуваться. Препарат также начинает растворяться и распространяться через раздутый матрикс. Длина цепи и степень замены могут быть изменены, чтобы изменить время, которое необходимо полимеру, чтобы раствориться.
Гуаровая смола - естественный неионогенный полисахарид, полученный из основания эндосперма гуарового дерева, которое произрастает в климатических зонах, характерных для Индии и Пакистана. Гуаровая смола – это галактоманнан, который в состоянии раздуваться и рассеиваться в холодной и горячей воде, формируя вязкий золь или гель. Норма гидратации и оптимальная вязкость галактоманнана сильно зависят от содержания, молекулярной массы, а также от распределения и размера ее частиц. Гуаровая смола обычно используется как покрытие, а также как сгущающий и стабилизирующий агент в целевых продуктах.
Желатин - обычно используемый естественный полимер, который получен из коллагена. Это разлагаемый микроорганизмами, биодеградабельный и биологически совместимый полимер, который был использован в качестве микросферы. Желатин может быть произведен двумя различными путями: щелочной процесс (известный как известкование) предназначается для амидных групп аспарагина и глутамина и гидролиза их в карбоксильные группы, и кислый процесс, который очень незначительно затрагивает амидные группы. Желатин, полученный щелочным путем обладает большей пропорцией карбоксильных групп, делающих его более отрицательно заряженным, чем желатин кислого процесса. Это важно, поскольку это определяет, какие терапевтические агенты могут быть успешно включены в желатин, и впоследствии остаться защищенными от деградации и высвободиться за расширенный период времени. Как было замечено, широкий спектр полимеров может быть использован как транспортное средство доставки препарата, а свойства высвобождения могут быть смоделированы, через варьирование физико-химических особенностей полимера. Свойства полимера должны служить дополнением выбранному АФК, и позволять взаимодействие настолько, чтобы функционировать эффективно в окружающей среде, для которой предназначена система доставки препарата.
5. Особенности и свойства полимеров
Как было описано в предыдущей главе, широчайший спектр полимеров используется в качестве транспортных средств для доставки препарата. Эффект управления выбранным полимером для высвобождения препарата зависит от физико-химических свойств полимера. Многие особенности полимера важны для определения поведения системы доставки препарата и последующего высвобождения активного компонента. Молекулярная масса - важная составляющая при выборе полимера, поскольку она воздействует на свойства полимерной системы доставки препарата. С увеличением молекулярной массы полимера также повышаются и значения величин его механических свойств. Полимеры с цепями высокой молекулярной массы могут часто быть более жесткими, чем полимеры низкой молекулярной массы вследствие увеличенных запутанностей между цепями. Кроме того, запутанности могут предотвратить вход водных молекул в большую часть полимерной сети; следовательно, растворение препарата замедляется и его высвобождение происходит значительно медленнее. Поведение полимеров при деградации обычно зависит от молекулярного веса полимерной цепи. Полимерные цепи подвергаются разделению, пока молекулярная масса не уменьшается до критического значения, посредством которого большая часть олигомеров в состоянии диффундировать. Это приводит к существенной деградации, и возникновению пор. Поры пропускают воду и способствуют высвобождению препарата. Также, если начальная молекулярная масса полимера будет высока, то процесс деградации будет идти медленнее, поскольку это займет больше времени, чтобы достигнуть критического сокращения молекулярной массы, которая провоцирует высвобождение препарата. Наоборот, если начальная молекулярная масса низка (приблизительно 4000 г/моль), высвобождение препарата немедленно происходит, подразумевая, что полимер практически сразу становится растворимым.
Степень кристалличности - другая особенность, которая является важным детерминантом функций полимерного устройства доставки препарата. Полимеры, которые имеют регулярные структуры и в состоянии достигнуть регулярной упаковочной организации цепей, описаны как кристаллические. Компактная упаковка цепей полимера увеличивает межмолекулярные взаимодействия, и полимер становится более упорядоченным и жестким, чем его аморфная копия. Кроме того, кристаллические области непроницаемы для диффундирующих молекул, и таким образом повышение кристалличности часто приводит к уменьшению проницаемости. Следовательно, кристаллические области чрезвычайно непроницаемы для воды, и норма гидролиза в кристаллических областях значительно уменьшена. Это позволяет управлять свойствами полимера, регулируя степень кристалличности.
5. Особенности и свойства полимеров
Как было описано в предыдущей главе, широчайший спектр полимеров используется в качестве транспортных средств для доставки препарата. Эффект управления выбранным полимером для высвобождения препарата зависит от физико-химических свойств полимера. Многие особенности полимера важны для определения поведения системы доставки препарата и последующего высвобождения активного компонента. Молекулярная масса - важная составляющая при выборе полимера, поскольку она воздействует на свойства полимерной системы доставки препарата. С увеличением молекулярной массы полимера также повышаются и значения величин его механических свойств. Полимеры с цепями высокой молекулярной массы могут часто быть более жесткими, чем полимеры низкой молекулярной массы вследствие увеличенных запутанностей между цепями. Кроме того, запутанности могут предотвратить вход водных молекул в большую часть полимерной сети; следовательно, растворение препарата замедляется и его высвобождение происходит значительно медленнее. Поведение полимеров при деградации обычно зависит от молекулярного веса полимерной цепи. Полимерные цепи подвергаются разделению, пока молекулярная масса не уменьшается до критического значения, посредством которого большая часть олигомеров в состоянии диффундировать. Это приводит к существенной деградации, и возникновению пор. Поры пропускают воду и способствуют высвобождению препарата. Также, если начальная молекулярная масса полимера будет высока, то процесс деградации будет идти медленнее, поскольку это займет больше времени, чтобы достигнуть критического сокращения молекулярной массы, которая провоцирует высвобождение препарата. Наоборот, если начальная молекулярная масса низка (приблизительно 4000 г/моль), высвобождение препарата немедленно происходит, подразумевая, что полимер практически сразу становится растворимым.
Степень кристалличности - другая особенность, которая является важным детерминантом функций полимерного устройства доставки препарата. Полимеры, которые имеют регулярные структуры и в состоянии достигнуть регулярной упаковочной организации цепей, описаны как кристаллические. Компактная упаковка цепей полимера увеличивает межмолекулярные взаимодействия, и полимер становится более упорядоченным и жестким, чем его аморфная копия. Кроме того, кристаллические области непроницаемы для диффундирующих молекул, и таким образом повышение кристалличности часто приводит к уменьшению проницаемости. Следовательно, кристаллические области чрезвычайно непроницаемы для воды, и норма гидролиза в кристаллических областях значительно уменьшена. Это позволяет управлять свойствами полимера, регулируя степень кристалличности.
Температура кристаллизации полимера Tg определяет поведение полимера при данной температуре. При низких температурах аморфные полимеры существуют в стекловидном состоянии, где не может произойти никакого крупномасштабного молекулярного движения. Стекловидные полимеры являются типично твердыми и ломкими по природе и, следовательно, коэффициенты распространения препарата в температурах ниже Tg будут низкими. При повышении температура полимеры подвергаются фазовому переходу, обозначенному как температура перехода кристаллизации, когда полимер изменяется от стекловидного состояния до эластичного. В результате этого перехода полимер подвергается резкому изменению свойств, таких как гибкость, проводимость и расширение в объеме. Следовательно, знание величины Tg и того, будет ли устройство функционировать выше или ниже Tg необходимо при проектировании устройства управляемого высвобождения.
Вязкость - важный параметр, особенно если есть необходимость сделать форму дозировки полимерного раствора в форме спрея для распыления. Оптимальная вязкость обязана достигать подходящего поверхностного конца и препятствовать тому, чтобы твердые частицы суспензии выпадали в осадок. Системы на основе ГПМЦ часто используются для покрытия твердых форм дозировки, употребляемых перорально, при вязкости 5 мПа*с может быть достигнута концентрация твердых частиц приблизительно 15 % w/w. Однако если вязкость увеличена до 50 мПа*с, то концентрация твердых частиц достигает только 5 % w/w. Система с более низкой вязкостью выгодна потому, что она разрешает большее содержание твердых частиц и более низкую растворяющую концентрацию, которая в свою очередь уменьшает продолжительность обработки, поскольку меньше времени тратится на удаление растворителя во время процесса покрытия. Однако если вязкость будет уменьшена слишком сильно, то получающаяся пленка полимера пострадает от плохой силы натяжения вследствие состава низкой молекулярной массы.
Когда полимер помещен в водную окружающую среду, он будет постепенно поглощать воду, и количество этой воды определено структурой полимера. Это имеет очень большое значение, поскольку устройства управляемого высвобождения будут неизменно функционировать в пределах водного раствора. Согласно природе водно-полимерного взаимодействия, полимер может быть классифицирован в одну из четырех групп. Гидрофобные полимеры - по существу непроницаемы для воды, и когда они помещены в водную окружающую среду, то поглощают очень немного воды. Эта непроницаемость приписана консервативности цепи полимера, высокой степени кристалличности и присутствия гидрофобных групп, такие как связи C-F. Гидрофильные полимеры типично поглощают больше чем 5 % воды и, как в случае с гидрофобными полимерами, это связано со свойствами полимера. Гибкость цепи, отсутствие кристалличности и присутствие групп, таких как аминогруппа, карбоксильная и гидроксильная - все это способствует поглощению молекул воды полимером. Кроме того, переменные уровни гидрофильности могут быть достигнуты сополимеризацией двух мономеров с различными степенями гидрофильности, такими как гидроксиэтил метакрулат и метил метакрулат.
Третий класс полимеров легко растворим в воде, даже при том, что они имеют высокую молекулярную массу. Типичные полимеры этого класса включают поли- (виниловый спирт), поли- (акриловая кислота) и поли- (этилен оксид). Четвертый тип полимеров по этой классификации представляют собой высокогидрофильньные или растворимые в воде полимеры, которые были поперечно связаны посредством ковалентных связей. Присутствие ковалентных связей создает полимер, неспособный распасться в воде, но позволяет осуществлять большую степень поглощения воды и, следовательно, выпуклостей полимера. Это придает такому полимеру особенности, которые не могут быть получены при использовании гидрофильньных линейных полимеров. Пористость может влиять на норму транспорта раствора через полимер. Пористые системы управляемого высвобождения содержат поры, достаточно большие, чтобы позволить распространению препарата произойти через полости с жидкостью, которой заполнены поры. Однако если поры ниже 200-500 ангстрем в размере, распространению можно препятствовать. Пористость также важна в системах деградации полимера. Поры позволяют молекулам воды входить в структуру полимера и начинать и деградацию полимера, и последующее высвобождение активного компонента. Раствор лекарственного препарата может тогда быть выпущен в циркуляторные системы. Это произойдет более быстро, если структура будет пористой по сравнению с плотным непористым полимерным матриксом.
Липкость - особенность, которой, если не управлять должным образом, соответственно, может привести к трудностям в процессе. Липкость связана с силами, которые должны отделять две поверхности, к которым присоединяется тонкая пленка раствора. Если раствор будет слишком липким для покрытия, то поверхности смежных покрытых пленкой форм дозировки будут придерживаться друг друга. Когда происходит отделение, у форм дозировки часто будут возникать дефекты, такие как неровности и остроты, которые могут поставить под угрозу целостность пленки и результата в нежелательных профилях высвобождения или непостоянных формах дозировки. Оптимальный уровень липкости, поэтому должен быть достигнут так, чтобы он придерживался ядра таблетки, но не других покрытий таблетки.
Смешивание и сополимеризация могут предложить рассчитанный профиль высвобождения препарата, который является промежуточным звеном двух составляющих частей. Микросфера, составленная из случайного сополимера l,6- (p-карбофенокси) гексан (КФГ) и себациевой кислота (СК) были использованы, чтобы управлять профилем высвобождения препарата. Вещество КФГ является ароматическим и подвергается деградации приблизительно за 1 год, тогда как СК является алифатическим веществом и разрушается за несколько дней. Следовательно, оптимизируя отношение сополимеров, норма деградации может быть подогнана, учитывая желательную продолжительность. Несовместимые мономеры могут также быть смешаны, чтобы достигнуть полимеров с отделенной от микрофазы окружающей средой. Две отличных друг от друга области могут впоследствии затронуть профиль высвобождения активного компонента. Если сильно гидрофобный мономер будет смешан с гидрофильным мономером, то гидрофильный мономер быстро высвободится, оставляя после себя пористую структуру. Пористая структура будет составлена главным образом из остающегося гидрофобного мономера. Поэтому, высвобождение препарата происходит в двухступенчатом процессе и не коррелирует с полной деградацией полимера, но с индивидуальным высвобождением самого мономера. Кроме того, области в пределах сополимеров и смесей могут взаимодействовать по-другому с объединенным препаратом. Модель лекарство p-нитроанилин (ЛНА), как наблюдали, была очень совместимой с КФГ, но менее совместимой с СК в пределах сополимерной системы КФГ-СК. Это привело к начальному высвобождению обедненных препаратом областей СК, сопровождаемых ЛНА-богатыми областями КФГ.
5.1 Механические свойства
Пленки покрытия должны обеспечивать физическую защиту для форм дозировки. Во время суровых условий процесса покрытия пленка должна обеспечить механическую силу, чтобы защитить таблетку от неуместного истощения. Покрытие должно также остаться неповрежденным, быть длительным и быть стойким к осколочным явлениям и взламыванию во время обработки. Механические свойства пленок могут часто приписываться молекулярной массе полимера. Было найдено, что ГПМЦ с молекулярной массой 33 000 показывает большую жесткость, чем ГПМЦ с молекулярной массой 20 000. Длина (высокая молекулярная масса) цепи приводит к увеличению запутанностей, которые создают более жесткую и более твердую структуру.
Механические свойства полимера также находятся под влиянием пропорциональности мягких и твердых сегментов в смесях и сополимерах. Смола была смешана с миноэфирами, которые функционируют как мягкие смолы. Мягкая смола пластифицирует шеллак, и в результате это приводит к большей гибкости полимера. Кроме того, если полярные группы включены в структуру полимера, то они осуществляют межмолекулярное взаимодействие через водородное соединение. Это приводит к формированию высоко структурированного матрикса, который тверд и имеет высокий предел прочности.
Механические свойства особенно важны для внедряемых устройств доставки. Имплант должен сохранять свою механическую интегративность в процессе доставки препарата, а затем разлагаться на нетоксичные побочные продукты. Если ПГК низкой молекулярной массы используется как трехмерная подпорка для доставки препарата, то полимер теряет целостность за несколько часов. Следовательно, структура не может функционировать эффективно в течение длительного периода. Поэтому норма деградации полимера должна соответствовать желательной продолжительности высвобождения препарата так, чтобы норма, которой управляют, была выполнена, а устройство не образовывало свалку в процессе деградации полимера.
Механические свойства также важны для разрывных форм дозировки. Внешнее покрытие полимера должно впитывать воду и разрываться после некоторой временной задержки. Поэтому, помимо водной проходимости важны механические свойства. Было выяснено, что если полимерное покрытие слишком гибкое, например RS Eudragit, капсулы будут только немного надорваны очень маленькими трещинами. Полный разрыв не будет происходить, и никакого существенного высвобождения препарата достигнуть не удастся. Однако если использовать в полимерных системах доставки менее гибкие и более ломкие полимеры такие, как этилцеллюлоза или ацетат пропионат целлюлозы, то разрыв будет достигнут, и произойдёт высвобождение препарата.
5.2 Параметры процесса
Простые управляемые распространением формы дозировки могут быть изготовлены, сжимая препарат с медленно растворимым контейнером. Нормой пригодности препарата управляет норма проникновения растворителя в матрикс. Этим может управлять пористость матрикса, которая в свою очередь может быть изменена силой сжатия, которая применена во время изготовления. Чем больше сила сжатия, тем больше силы прилипания между полимерными единицами и соответственно, более плотным и менее пористым будет матрикс. Кроме того, присутствие гидрофобных добавок может быть введено, чтобы уменьшить эффективную пористость, ограничивая число пор, через которые может произойти проникновение растворителя.
Другой маршрут обработки – пленочное покрытие. Это требует того, чтобы суспензия пленочного покрытия была сформирована с соответствующей плотностью, поверхностным натяжением и вязкостью. Физические свойства суспензии контролируют смачивание, распространение и прилипание капель на твердой форме дозировки. Например, если концентрация ГПМЦ удвоена от 6 до 12% w/w, то наблюдается почти десятикратное увеличение вязкости. Это происходит из-за большого гидродинамического объема беспорядочно намотанных цепей полимера и их стабилизированных водородными связями молекул воды, которые сопротивляются потоку, что в результате приводит к высоким значениям вязкости. Если вязкость будет слишком высока, то пленка распространится по поверхности плохо, и это может привести к неравному поверхностному натяжению.
Как только оптимальная суспензия покрытия была сформирована, непокрытые твердые формы дозировки помещаются в цилиндрический барабан, такой как, например единица Accelacota. У единицы есть горизонтальный вращающийся цилиндрический барабан с перфорированной кривой внутренней поверхностью. Концы барабана - сформированы конически так, чтобы таблетки в барабане были перевернуты и смешаны со стороны. Есть перегородки, чтобы помочь смешиванию, и горячий воздух входит в барабан, поскольку таблетки беспорядочно крутятся. Поскольку таблетки непрерывно крутятся, жидкость покрытия распыляется в барабан при определенной температуре, скорости и давлении. Затем уже покрытые пленкой таблетки извлекаются.
Покрытие пленкой также используется в устройствах с осмотическим контролем. Устройство формируется сжатием препарата в таблетку при помощи подходящего осмотического давления. Это может часто представлять проблемы, поскольку компоненты осмотических устройств имеют тенденцию к плохой текучести и свойствам сжатия. Полуводопроницаемая мембрана тогда применена к ядру таблетки. Покрытие, обычно АЦ применяется, используя основанный на растворении процесс, чтобы гарантировать образование гладкой поверхности в итоге. Мембрана покрытия тверда и нераздувающаяся, чтобы поддержать целостность системы во время высвобождения препарата. Следовательно, когда в каждой системе сверлится отверстие доставки лазером или высокоскоростным механическим устройством, необходимо соблюдать аккуратность, чтобы не повредить покрытие. Хотя шаги обработки сложны, осмотические устройства успешно использовались во многих коммерческих продуктах.
Монолитные системы обычно используются для управляемой доставки и высвобождения противозачаточных стероидов. ПМК обычно использовалась для длительного высвобождения прогестерона и β-оэстрадиола. Устройства изготовлены, растворяя препарат и полимер в дихлорметане. Растворитель испарен под низким давлением, а твердый остаток прессуют в необходимую желательную форму. В этой процедуре остаток полимера помещен в более низкую половину горячей формы. Форма закрыта герметически от доступа воздуха, и лишний полимер вытесняется. Затем форма охлаждается, и полимерное устройство соответствующей формы извлекается. Системы типа резервуар - обычно водно-нерастворимые полимерные материалы, упаковывающие ядро препарата. Выбранная полимерная мембрана, такая как хитозан, присоединяется к обратной стороне мембраны при помощи неудаляемого адгезивного агента, таким образом, создавая пустой бассейн. Маленькое круглое отверстие делается в обратной стороне мембраны. Отдельный полимерный лист с круглым отверстием сопоставляется с хитозановой мембраной, таким образом, бассейн совпадает с круглым отверстием. Затем устройство прессуется и оставляется на некоторое время, чтобы высохнуть. Тонкий слой чувствительного к давлению адгезивного агента нанесен на внешнюю поверхность для функционирования устройства, чтобы обеспечить его прилипание к коже. Форма препарата введена через отверстие на обратной стороне резервуара и запечатана клейким участком. Трансдермальная система доставки после этого может быть помещена на кожу для высвобождения активного компонента в кожу. Микрочастицы препарата или сверхтонкие капельки препарата, включенные в капсулы размером в несколько микрон - называются микросферами. Микросферы могут быть изготовлены отвердеванием эмульсии (скапливание мелких капель), растворяющим испарением или растворяющим извлечением. Типичное растворяющее испарение выполнено в эмульсиях нефти в воде или нефти в нефти, внутренняя нефтяная фаза которых составлена из препарата, полимера и растворителя. Полимер в воде превращен в эмульсию ультразвуком в органической фазе. Полимерные частицы химически поперечно связаны или укреплены термообработкой и остаточная органическая фаза удалена. Растворимые в воде молекулы препарата могут быть включены в микросферы вовлечением их в полимерные растворы. До 10 % w/w препараты могут иногда быть пойманы в ловушку в микросферах этим подходом. Диаметр микросферы может быть затронут различными параметрами обработки, такими как норму размешивания, концентрация добавок и внутренний объема фазы.
Микросферы также могут быть изготовлены объединением мелких капель. Это превращается в 4-хэтапный процесс, который переносит макромолекулы со свойствами пленок из растворенного состояния (стадия 1) через промежуточную фазу, фаза коацервации мелких капель (стадия 2), в фазу, в которой есть пленка вокруг каждой частицы препарата (стадия 3); наконец полимерная пленка укрепляет и упаковывает препарат (стадия 4). Стадия 1 представляет собой двухфазную систему, которая вовлекает растворенный препарат в сольватированный пленкообразующий материал. Стадия 2 - система с тремя фазами, включающая в себя внешнюю фазу растворенного полимера, растворенный препарат и новую фазу, названную фазой коацервации. Обогащение полимера каплями в растворителе происходит в результате изменений в pH факторе, температуре, ионной силе. Во время фазы 3 непрерывная полимерная пленка упаковывает каждую частицу. Обогащая коацерват, переход из состояния золя в состояние геля имеет место, и система с тремя фазами возвращается в двухфазную. Наконец в стадии 4 полимер укрепляется и становится возможным сформировать микросферы в формах дозировки, таких как капсулы, гранулы и суспензия.
Микроинкапсуляция может также быть выполнена, используя процедуру атомизации. Микронные или наноразмерные частицы суспензии препарата атомизируются во внешней водной фазе или, в случае эмульсии препарата - в водном растворе, содержащем мономерные реактивы или преконденсаты. Под влиянием высокой температуры во время распыления формирующих пленки материалов полимеризируют или поликонденсируют. В соединении испаряется водная фаза, и обогащение формирующих пленки мономеров или поликонденсатов имеет место на поверхности препарата. Полимер укрепляет и формирует сеть вокруг частиц препарата, и сформировывает микросферы.
6 Будущие тенденции
Полимерные системы доставки препарата - постоянно развивающаяся область терапии и, следовательно, новые технологии и способы действия постоянно появляются. Главное продвижение в будущем будет развитие непрерывного датчика глюкозы, чтобы лечить диабет. Датчик был бы идеально чувствителен к малейшим изменениям содержания глюкозы, оставался бы в контакте или с кровью, или с физиологической жидкостью и быстро и надежно отвечал бы на любые колебания глюкозы в крови. Он мог бы быть в форме гидрогеля, который в состоянии ответить на окружение, такое как изменение pH фактора, индуцированное ферментативной реакцией, которая происходит только в присутствии субстрата, такого как глюкоза. Это можно было бы регулировать высвобождением инсулина из системы гидрогеля.
Будущее направление развития, которое важно - это способность доставить нуклеиновые кислоты к единичной ткани или клеткам. Следовательно, подход требует, чтобы результаты устойчивой экспрессии гена предназначались для контроля сайта связывания. В прошлом были сделаны попытки, чтобы использовать положительно заряженные полимеры, такие как полилизин, связав его с отрицательно заряженной дезоксирибонуклеиновой кислотой (ДНК) в устойчивой конфигурации. Однако это было потенциально ядовито и иммуногенно. По существу, дополнительная работа должна быть направлена на поиск новых полимеров с подходящими лигандами для связи с ДНК.
Хотя были сделаны обширные усовершенствования для лечения рака, нежелательные взаимодействия между препаратом и системами его доставки всё еще происходят. Продвижением, которое существенно изменило бы лечение рака, могло бы быть устройство, которое могло бы регулировать высвобождение лекарства в любое время, образец или шкала. Это может позволить комбинациям методов лечения управляться, первоначально высвобождая ингибиторы ангиогенеза, чтобы атаковать опухолевые клетки, сопровождая это хемотерапевтическими препаратами, чтобы разрушить оставшуюся опухоль. Такое устройство могло бы поддерживать пациента на антиангиогенезной терапии в течение довольно долгого времени.
C анализом существующего оборудования для производства таблеток можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков