Каталитическая активность наночастиц золота
Золото обычно рассматривается как инертный металл, но оказалось, что наночастицы золота с размерами 3-5 нм в диаметре каталитически активны для нескольких химических реакций. Мы обсуждаем причину этого эффекта, фокусируя внимание на том, что химическая активность золота может зависеть от размера частицы. Часть низко скоординированных атомов золота обладает приблизительно одинаковой каталитической активностью, при этом атомы золота на краях и углах наночастицы являются наиболее активными. Этот эффект объясняется с использованием расчетов функционала плотности.

Катализ широко используется в многотоннажном производстве обычных химикатов, а также в производстве специальных химических продуктов и фармацевтических препаратов. Производство топлива – характерный пример: бензин, который используется в автомобилях, требует, по крайней мере, десять различных катализаторов в процессе производства из исходного сырья. Технологии решения экологических проблем тоже в значительной степени связаны с катализом; наилучшим примером является каталитическое преобразование выхлопных газов каждой машины. Показано, что производство более 20 % валового национального продукта индустриально развитых стран так или иначе связано с катализом.
При гетерогенном катализе участвующие в реакции молекулы адсорбируются на каталитически активных поверхностях твердых тел. Химические связи, разорванные и сформированные на поверхности, в конечном итоге реализуются в жидкой или газовой фазе. Многие из гетерогенных каталитических процессов, используемых в современной промышленности сегодня, базируются на малых частицах каталитически активных материалов, обычно диаметром 1-10 нм, фиксированных на пористой структуре. Эффект от использования наночастиц является результатом большой контактной поверхности между активным материалом катализатора и окружающим газом или жидкостью. Это означает, что каталитический материал используется эффективно. Одна из наиболее интересных научных и технологических перспектив ассоциируется с исследованием состава и атомной структуры наночастиц как катализаторов. Следующий шаг состоит в том, чтобы синтезировать эти частицы с возможностью максимального контроля состава и структуры. Современные методы нанотехнологий дают огромные возможности для будущего развития, как в области синтеза, так и в области анализа гетерогенных катализаторов, связанных с использованием наночастиц.
Увеличение площади поверхности не является единственной причиной использования наночастиц в гетерогенном катализе. Золото обычно рассматривается как химически инертное вещество, но в 1987 году Харута и его коллеги показали, что наноразмерные (меньше 5 нм) частицы золота могут быть очень эффективными катализаторами. Это однозначно показывает, что каталитические свойства определенного материала могут сильно зависеть от размера частиц. Тот факт, что частицы золота диаметром 5 нм или меньше обладают уникальными каталитическими свойствами, инициировали попытки как объяснения весьма неожиданного эффекта, так и поиска химических реакций, где катализатором могло бы служить золото. В некоторых случаях каталитическое участие наночастиц золота позволяет значительно снизить температуру реакции по сравнению с существующими процессами, что в свою очередь является многообещающим фактором для формирования энергосберегающих процессов.
Здесь мы обсуждаем некоторые причины, почему малоразмерные частицы золота каталитически активны. Предложено несколько вариантов объяснения каталитической активности этих частиц, включая эффекты размерного квантования, перенос заряда от матрицы и к ней, либо напряжение в матрице, переход атомов кислорода от матрицы к наночастице и обратно, возможность окисления золота, а также роль совершенно нескоординированных атомов золота в наночастице. Вполне вероятно, что некоторые из вышеназванных эффектов осуществляются одновременно. В этом обзоре мы концентрируем внимание на некоторых эффектах, которые связаны только с размером частиц. Этот эффект всегда присутствует вне зависимости от материала матрицы.
Реакционная способность золота и наночастиц золота
Способность поверхности металла формировать химические связи с газом является мерой инертности поверхности. Инертность металла хорошо иллюстрируется способностью его поверхности к окислению, то есть диссоциативной хемосорбцией кислорода. Рисунок 1 показывает величины рассчитанной энергии хемосорбции кислорода на ряде переходных металлов. Все результаты получены для адсорбции либо на объемноцентрированной кубической поверхности для Fe, Mo и W, либо для гранецентрированной кубической поверхности (другие металлы). Можно видеть, что металлы, расположенные выше и слева от золота в периодической таблице, обладают большими энергиями хемосорбции и что металлы, соседствующие с золотом, реагируют с кислородом слабо. Золото является единственным металлом с эндотермической энергией хемосорбции, что означает, что золото не присоединяет кислород вовсе. Это иллюстрируется хорошо известным фактом, что золото является инертным по отношению к кислородной атмосфере.
Рис. 1. Диссоциативная энергия хемосорбции для кислорода на поверхностях переходных металлов по отношению к молекуле в вакууме, рассчитанные по теории функционала плотности (ТФП).

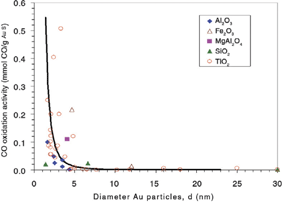
Тенденции отображенная на рисунке 1 можно понять, рассматривая химические связи, которые образуются в результате спаривания кислородных валентных состояний и d-состояний металла в так называемой модели d-зоны. Золото имеет d-состояние с такой малой энергией, что взаимодействие с 2p-состоянием кислорода является отталкивающим. Таким образом, маловероятно, что золото может быть хорошим катализатором для реакции окисления. Несмотря на это, окисление СО (что имеет место в основанных на платине катализаторах, используемых в выхлопных системах автомобилей) является одной из реакций, где наночастицы золота служат хорошим катализатором даже при комнатной температуре. Это иллюстрируется рисунком 2, который представляет собой экспериментальные данные по активности окисления СО, как функции размера каталитических наночастиц золота при использовании различных материалов в качестве матрицы. Ясно, что активность сильно зависит от размера наночастиц золота, и что только частицы размером менее 5 нм демонстрируют каталитическую активность. Более того, можно заметить также, что активность зависит от материала матрицы. Эти эффекты достаточно важны, но результаты, представленные на рисунке 2, указывают, что все же наиболее важным является размер частиц. Таким образом, мы концентрируем внимание на внутренней каталитической активности частиц золота, учитывая также дополнительные эффекты, чтобы создать полную картину каталитической активности золота.
Рис. 2. Зависимость каталитической активности от размера частицы золота в реакции окисления СО при 0°С для различных материалов матрицы.
Теоретические расчеты на базе функционала плотности
Чтобы исследовать, каким образом размер наночастиц определяет такое существенное влияние на каталитическую активность, мы применили теорию функционала плотности с целью промоделировать поведение адсорбированных молекул на наночастицах золота. Прежде чем моделировать кластер золота размерами 3-5 нм с тысячами атомов, мы промоделировали кластер, состоящий из 10 атомов. При моделировании мы не включали в рассмотрение материал матрицы с тем, чтобы результаты были связаны только с самими наночастицами золота. Это, конечно, слишком большое упрощение реальной каталитической системы, но этого достаточно, чтобы качественно проиллюстрировать связь эффекта с размером частицы. Ниже мы рассмотрим реакцию окисления СО как тестовую реакцию.
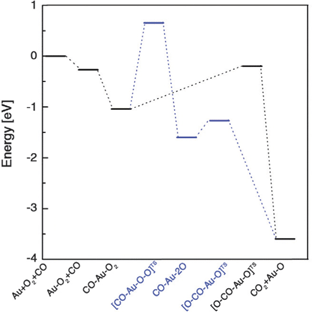
Рассчитанная энергетическая диаграмма двух возможных путей окисления СО представлена на рисунке 3. По одному варианту диссоциация О2 происходит до реакции с СО с тем, чтобы образовать СО2; в другом случае происходит реакция между молекулярным О2 и СО. Результаты показывают, что окисление СО возможно при комнатной температуре. Видно также, что реакция между молекулярным О2 и СО предпочтительнее – она требует значительно меньше энергии активации, чем реакция, включающая диссоциацию О2. Одиночный адсорбированный атом кислорода, возникающий в результате реакции между О2 и СО, будет реагировать с другой молекулой СО, следуя последней половине второго варианта.
Рис. 3. Рассчитанные энергии реакции для окисления молекулы СО на кластере Au10. Представлены два пути реакции: первый – диссоциация О2 до реакции с СО с образованием СО2, второй – реакция молекулы О2 непосредственно с СО.
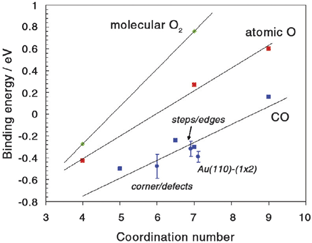
Энергетическая диаграмма обнаруживает также, что может быть важным для понимания способности наночастиц золота действовать как катализатор. Оба – О2 и СО – связываются с поверхностью кластера. В этом состоит резкая противоположность случаю протяженной поверхности золота. Таким образом, полезным для объяснения разницы между наночастицами золота и протяженной поверхностью золота может быть рассмотрение координационного числа атомов золота, которые вступают в реакцию с партнерами - О2, О или СО (рис. 4). Атомы золота с плотно упакованной грани имеют 9 атомов в соседстве, на ребре координационное число – 7, а на вершинах малой частицы – ещё меньше: 3 или 4. Рисунок 4 показывает, что энергия связи уменьшается практически линейно с уменьшением координационного числа.
Рис. 4. Корреляция между энергиями связей О2, О и СО с атомом золота для различных поверхностей и кластеров. Энергии связей рассчитаны с использованием ТФП.
Малые частицы имеют относительно большое число низко скоординированных атомов золота, которые расположены на ребрах и, в особенности, на вершинах частицы. Вышеприведенный анализ указывает, что эти атомы золота способны связывать СО и кислород, что является предпосылкой каталитической реакции. Таким образом, понятно, что на этих атомах окисление СО возможно и при комнатной температуре – энергетические барьеры малы и, что особенно важно, промежуточные соединения и СО2, которые образуются, лишь слабо связаны, так что необходимо поддерживать высокую температуру, чтобы сохранять часть поверхности свободной.
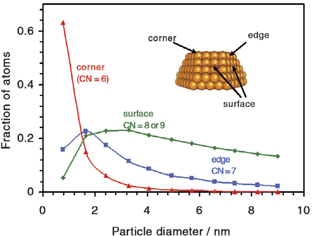
Если низко скоординированные угловые состояния (вершины) являются активными состояниями, тогда каталитическая активность соизмерима с числом низко скоординированных атомов на частицах, но не с величиной поверхности. Рисунок 5 демонстрирует расчетные зависимости доли атомов, которые расположены либо на углах (вершинах), краях (ребрах), или на поверхности верхней части усеченного октаэдра (гранях) в зависимости от диаметра частицы. Ясно, что общее число поверхностных атомов изменяется лишь немного, когда размер частицы изменяется от 10 нм до 2 нм. Однако, доля углов возрастает значительно, когда размер частицы становится меньше 4 нм, и пропорциональна d-3, когда диаметр частиц уменьшается. Возрастание доли угловых атомов совпадает с возрастанием активности окисления СО при уменьшении размера частиц золота (рис. 2). Это поддерживает гипотезу, что число атомов, расположенных в углах наночастиц, играет основную роль в активности стимулированного золотом катализа.
Рис. 5. Расчетная зависимость доли атомов золота, с разным координационным числом, от величины диаметра одинаковых по форме наночастиц. Врезка иллюстрирует усеченный октаэдр и положение угловых, краевых и поверхностных атомов.
Результаты расчета, показывающие, что сила хемосорбции с уменьшением координационного числа возрастает, подтверждается большим числом недавних экспериментов. Установлено, что температура десорбции молекул СО с поверхностей частиц золота возрастает с уменьшением координационного числа. Это указывает, что хемосорбция становится эффективнее, что согласуется с расчетами. Фактически оценки энергии хемосорбции близки к тем величинам, которые получены расчетным путем, как показано на рис. 4.
Эксперименты показывают, то низко скоординированные состояния на плотно упакованной поверхности золота (111), созданной ионной бомбардировкой, также активны для реакции окисления СО. Недавно Ксу и его коллеги показали, что нанопористое золото, используемое без подложек, является активным катализатором для реакции окисления молекул СО. Нанопористый Au-катализатор с размером пор меньше 6 нм создается путем вытравливания серебра из сплава золото-серебро. Эти результаты дают дополнительную поддержку предположению, что металлическое золото изначально каталитически активно, если координационное число атомов мало.
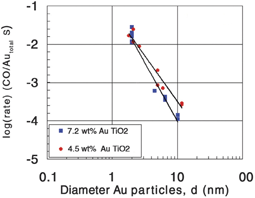
Доказательство соответствия каталитической активности наночастиц золота и числа угловых атомов представлено Овербьюри и соавторами. Они установили размерную зависимость активных состояний путем связи окислительной активности молекул СО в присутствии катализатора Au/TiO2 с размером частиц золота, сопоставляя результаты исследования с помощью методики тонкой структуры поглощения рентгеновских лучей (EXAFS) непосредственно. Размер частиц варьировался путем нагревания образцов катализатора. Это было сделано, чтобы уменьшить возможные флуктуации при приготовлении различных партий катализаторов. Рисунок 6 показывает корреляцию для содержания золота 4,5% и 7,2% при 0°С. Тангенс угла наклона прямых, проведенных через экспериментальные точки, составляет -2,1 и -2,8 соответственно. Это указывает, что углы и менее выраженные краевые состояния являются доминирующими для 7,2%-ного состава, в то время как краевые и менее выраженные угловые состояния дают вклад для состава 4,5%.
Рис. 6. Зависимость активности при 0°С от диаметра частицы золота для двух серий Au/TiO2–катализаторов, содержащих 4,5% и 7,2% золота по массе, соответственно.
В исследованиях Джансиса и других, 100 геометрическая модель для частиц золота в матрицах TiO2MgAl2O4 и Al2O3 была сконструирована на основе данных по сканирующей электронной микроскопии (STEM) и EXAFS. Это дает возможность точно подсчитать число угловых атомов в указанных матрицах. Путем сравнения их каталитических активностей было найдено, что частота колебаний для Au/TiO2- и Au/MgAl2O4–катализаторов одинакова и любая разница в каталитической активности между этими двумя материалами может, таким образом, быть связана с разницей в размере частиц и их форме, что определяет полное число низко скоординированных угловых атомов. Частота колебаний на один угловой атом для Au/Al2O4 приблизительно в 4 раза меньше, что указывает на дополнительное влияние матрицы в этом случае. Этот результат прекрасно демонстрирует, что каталитическая активность наночастиц золота связана не с одним, а с несколькими факторами.
Наноразмерные эффекты, обнаруженные в гетерогенном катализе, наилучшим образом демонстрируются значительной каталитической активностью наночастиц золота. Мы до сих пор не понимаем в деталях многих эффектов, дающих вклад в эту активность, но, тем не менее, подчеркиваем один очень важный эффект – возрастающую реактивную способность низко скоординированных атомов золота. Эти атомы доминируют на наименьших по размерам наночастицах, что дает большие возможности для объяснения каталитической активности наночастиц золота.
Мы достаточно далеки пока от использования всех возможностей катализа на базе золота, но эта система чрезвычайно интересна. Одним из интригующих свойств катализа на наночастицах золота состоит в том, что они могут стимулировать различные реакции при комнатной температуре и даже ниже нее. Это дает возможность сохранения энергии во многих каталитических процессах и может служить интересным аналогом энзимного катализа, который также протекает при комнатной температуре.
Мы также должны иметь возможность синтезировать наночастицы золота в форме, которая стабильно и существует долгое время. Понимание взаимодействия частиц золота и содержащей их матрицы является ключевым вопросом. В конечном итоге возникает вопрос, существуют ли другие классы каталитических материалов, где наноразмерные эффекты так же значительны, как в случае с золотом. Ясно, что ещё нужно многое выяснить.
Бритт Волбек, Тон Джансенс, Бьорн Клаусен, Ханне Фальсиг, Клаус Кристенсен
http://www.nanotoday.com