ТЕХНОЛОГИЯ ПРОИЗВОДСТВА ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают гидратацией окиси этилена. Свойство вступать в реакцию поликонденсации обеспечивает ему стабильно растущий спрос в секторе производства полиэфиров, а уникальная возможность не замерзать при пониженных температурах делает его незаменимым в производстве антифризов.

Свойства продукта и технические характеристики
Этиленгликоль представляет собой бесцветную вязкую гигроскопичную жидкость без запаха, сладковатого вкуса. Температура кипения 197,6 °С, температура плавления –12,7 °С, плотность – 1,1132 г/см3. Хорошо растворим в воде, спиртах, кетонах и др., умеренно - в бензоле, толуоле, диэтиловом эфире. Водные растворы этиленгликоля замерзают при низких температурах (до -70 °С).
Этиленгликоль ядовит. При попадании внутрь действует на центральную нервную систему и почки, смертельная доза - 1,4 г/кг. Предельно допустимая концентрация в воздухе рабочей зоны - 5 мг/м3. Относится к третьему классу опасности. Из-за низкой упругости паров этиленгликоль не вызывает острых отравлений при вдыхании.
При транспортировке этиленгликоль должен быть расфасован только в алюминиевые бочки или бочки из коррозионно-стойкой стали. Этиленгликоль, упакованный в бочки, транспортируют в крытых транспортных средствах всеми видами транспорта, а также в железнодорожных цистернах. Хранят в бочках в закрытых не отапливаемых складах.
В нижеследующей таблице кратко представлены технические требования к моноэтиленгликолю высшего и первого сорта согласно ГОСТ 19710-83.
Технические характеристики этиленгликоля (согласно ГОСТ 19710-83)
| Показатель | Значение | |
| Высший Сорт | Сорт 1 | |
| Массовая доля этиленгликоля. %. не менее | 99,8 | 98,5 |
| Массовая доля диэтиленгликоля. %. не более | 0,05 | 1,0 |
| Цвет в единицах Хазена, не более: | 5 | 20 |
| после кипячения с соляной кислотой | 20 | - |
| Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| Массовая доля железа. %. не более | 0,00001 | 0,0005 |
| Массовая доля воды, %, не более | 0,1 | 0,5 |
| Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 | 0,005 |
| Показатель преломления при 20° С | 1,431-1,432 | 1,430-1,432 |
| Пропускание в ультрафиолетовой области спектра,%, не менее, при длинах волн, нм: 220 | 75 | - |
| 275 | 95 | - |
| 350 | 100 | - |
Этиленгликоль был впервые получен в 1859 году французским химиком Шарлем Адольфом Вудсом. Первое промышленное производство этиленгликоля основывалось на гидролизе дихлорэтана водным раствором соды при 200 °С и давлении 10 МПа. Он использовался в небольших масштабах в период Первой мировой войны в качестве теплоносителя и компонента взрывчатых веществ. Широкое промышленное производство началось в 1937 году, когда был разработан процесс прямого окисления этилена в этиленоксид, что обеспечило доступным сырьем производство этиленгликоля. В настоящее время мировое производство этиленгликоля основано на гидратации окиси этилена.
В период Второй мировой войны этиленгликоль получил широкое распространение в авиации, где он стал использоваться в качестве охладителя радиатора и антиобледенителя стекол. В последующие годы сферы использования этиленгликоля расширялись, появлялись новые продукты на его основе. На сегодняшний день производство этиленгликоля является важной составляющей химической промышленности. Потребность в этом продукте в мире с каждым годом увеличивается.
Промышленные методы производства этиленгликоля
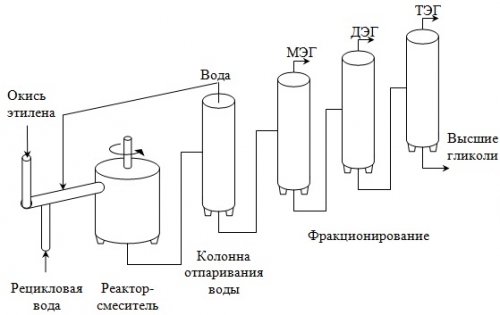
В настоящее время основным промышленным способом получения этиленгликоля является гидратации окиси этилена. Реакция включает раскрытие эпоксидного цикла и образование гидроксильных групп. Она проходит в воде при небольшом нагревании и несколько повышенном давлении в присутствии кислотного катализатора.
Процесс проводят в нейтральной среде под давлением 10≈12 кгс/см2 при 160≈180 °С в непрерывно действующем автоклаве, который представляет собой стальную колонну высотой 10 м и диаметром 1 м. Раствор, выходящий из автоклава, упаривают в двух- или трехкорпусном выпарном агрегате и фракционируют. В процессе производства моноэтиленгликоля получаются также ди- и триэтиленгликоли.
С установки выходит достаточно чистый этиленгликоль, который удовлетворяет жестким требованиям, предъявляемым производителями полиэтилентерефталата и полиэфирных волокон. Ниже представлена схема установки по получению этиленгликоля и ориентировочный материальный баланс процесса.
Материальный баланс процесса синтеза этиленгликоля
| Сырье | Масса, кг | Продукты | Масса, кг |
| Этиленоксид | 327 | Моноэтиленгликоль | 454 |
| Вода (избыток) | 268 | Тяжелые гликоли* | 16 |
| Непрореагировавшая вода | 2542 |
* Ди-, три- и тетраэтиленгликоли
Этиленгликоль также может быть получен взаимодействием этиленоксида с СО2 при температуре 80-120°С и давлении 2-5 МПа в присутствии галогенидов щелочных металлов, аммония или аминов с последующей гидратацией образующегося этиленкарбоната.
Этиленгликоль образуется также при ацетоксилировании этилена с последующим гидролизом моно- и диацетатов этиленгликоля (катализаторами служат хлориды Pd, Li, нитраты Fe, Ni). Недостаток метода - высокая коррозионность среды, трудность отделения солей и продуктов реакции, необходимость регенерации катализатора.
При уменьшении добычи нефти и резком увеличении стоимости этилена представляют интерес методы синтеза этиленгликоля из альтернативного сырья: синтез-газа, метанола, СО и воды при т-ре 200°С и давлении 70 МПа либо в жидкой фазе при 40 МПа в присутствии оксидных медно-магниевых или родиевых катализаторов; из СО и Н2 - через диэфиры щавелевой кислоты.
Так, компания IPCI (International Polyol Chemicals Inc., США), работающая в области создания новых, «зеленых» химических технологий, разработала новый способ производства многоатомных спиртов (этиленгликоля, пропиленгликоля, бутандиолов и глицерина) из сахаров любого происхождения. По этой технологии с 2004 года уже работает завод в Changchun (Китай) мощностью 10 тыс. тонн в год.
Области применения этиленгликоля
Этиленгликоль применяют в химической, текстильной, автомобильной, авиационной, электротехнической промышленности, в производстве гидравлических и закалочных жидкостей, полиуретанов, алкидных смол и др.
Два основных пути использования этиленгликоля абсолютно различны. С одной стороны, он применяется как потребительский продукт, а с другой – как сырье для более сложных химических процессов. Вследствие низкой температуры замерзания этиленгликоль является основным ингредиентом автомобильного антифриза. В зависимости от концентрации этиленгликоля в водном растворе можно получить основу охлаждающей жидкости с температурой замерзания от 0°С до 70°С. Водные растворы этиленгликоля не расширяются при замерзании и не образуют сплошной твердой массы, а превращаются в кашицеобразную рыхлую массу, объем которой больше первоначального только на 0,25-0,30%.
Из-за высокой химической активности он используется как мономер в производстве полиэфиров и полиэтилентерефталата, пластмассы для изготовления широко распространенных пластиковых бутылок для воды и напитков. Широкое распространение получили синтетические полиэфирные волокна на основе ПЭТФ.
На указанные области применения – в качестве антифриза, в производстве ПЭТФ и полиэфиров - приходится до 98% общего количества этиленгликоля, производимого в мире. Кроме того, этиленгликоль иногда используется в авиации в качестве антиобледенителя для ветровых стекол. Две гидроксильных группы в молекуле этиленгликоля делают его пригодным также для производства поверхностно-активных веществ и латексных красок. Смесь моноацетата и диацетата этиленгликоля представляет собой отвердитель, используемый в литейном производстве при изготовлении самоотверждающихся формовочных и стержневых смесей с жидким стеклом.
Низкомолекулярные и высокомолекулярные полиэфиры (ПЭГ) используются в качестве мягких лекарственных форм; гидрофильной основа для кремов, зубных паст, компонент лосьонов, дезодорантов, шампуней; эмульгаторов, диспергаторов, антистатиков в текстильной и кожевенной промышленности; пластификаторов в целлюлозно-бумажной промышленности; компонентов смазочно-охлаждающих жидкостей; в производстве полиуретанов; растворителей и добавок в лаках и красках; в производстве вискозы.
На основе насыщенных сложных эфиров, получаемых взаимодействием этиленгликоля с себационовой, ортофталевой кислотами, изготавливают полиэфирные клеи. Этиловый эфир этиленгликоля (этилцеллозольв) используется в качестве растворителя (нитро- и ацетилцеллюлозы, смол, лаков и др.), некоррозивных антифризов, антикристаллизационных присадок к моторным топливам и т.д. Гигроскопичность обуславливает применение этиленгликоля в качестве увлажнителя для текстильных волокон, бумаги, кожи и клеев.
Этиленгликоль также используют для ускорения сушки и улучшения эластичности покрытий алкидных красок на масляной основе, в качестве осушающего агента природного газа и моторных масел, для получения чернил, пестицидов, морилок, протрав и многих других продуктов.
C текущей ситуацией и прогнозом развития российского рынка моноэтиленгликоля можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Рынок моноэтиленгликоля в России».