Сопряженное окисление Пероксид водорода может непосредственно образовываться в реакционной системе in situ и тут же расходоваться на окисление субстрата. Этот подход рассматривается как одно из наиболее перспективных направлений не только для окисления ароматических соединений, но и многих других углеводородов, включая парафины [4, 45, 46]. Использование пероксида по мере его образования из Н2 и О2 позволяет значительно увеличить селективность полезного использования H2O2. Это типичный пример сопряженного процесса, протекающего с участием вещества-«жертвы» [47]: 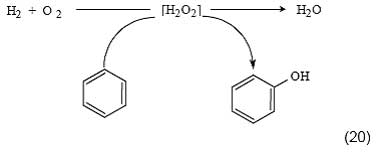
Напомним, что механизм сопряжения заключается в том, что промежуточное вещество, образующееся при протекании первичной реакции, частично используется для осуществления вторичной реакции, которая сама по себе в этих условиях не происходит. В данном случае первичной реакцией является окисление водорода в H2O через промежуточное образование Н2О2, а вторичной реакцией -окисление бензола в фенол.
Работы в этом направлении интенсивно ведутся во многих лабораториях мира с использованием разнообразных катализаторов и приемов [34, 45, 48]. Наиболее эффективные катализаторы включают платину или другой благородный металл, который вместе с оксидом ванадия наносится на силикагель. На таком катализаторе в растворе уксусной кислоты бензол почти со 100%-ной селективностью окисляется в фенол. Однакоселективность реакции по водороду все еще остается невысокой и составляет 10-15% (это значит, что на образование 1 моль фенола расходуется 7-8 моль водорода). Сопряженное окисление водорода и бензола может протекать также в газовой фазе при повышенной температуре [49]. Помимо окисления водорода, в качестве первичной реакции может выступать процесс окисления других молекул, например монооксида углерода [50]: 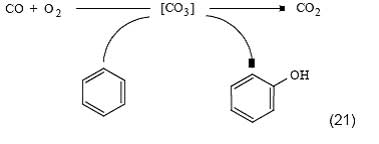
Сопряжение может быть организовано также в сочетании с окислением восстановленной формы металла в растворах: 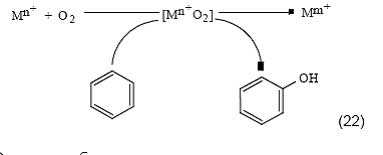
Окисление бензола здесь стимулируется окислительными превращениями металлов: Fe2+ → Fe3+, Sn2+ → Sn4+ [51], Cu+ → Cu2+ [52], Zn0 → Zn2+ [53]. Иногда, как в случае использования цинковой пыли, для протекания реакции требуется введение в систему дополнительного катализатора, в качестве которого могут выступать соли переходных металлов. Недостаток сопряженных реакций состоит в трудности подбора таких условий, которые были бы оптимальными как для образования сопрягающего промежуточного соединения в первичной реакции, так и для его эффективного использования во вторичной реакции. В последние годы широкое развитие получают работы по исследованию реакций сопряженного окисления углеводородов в электрохимических ячейках, представляющих собой реакторы типа топливных элементов [54—56]. Проведение реакций в таких устройствах открывает дополнительную возможность для управления реакцией посредством регулирования электрического тока, пропускаемого через ячейку.В заключение данного раздела отметим, что реакция окисления бензола в фенол, вероятно, является рекордсменом по разнообразию подходов, количеству испытанных каталитических систем, а также по объему усилий, предпринимаемых исследователями для осуществления этой реакции. Сравниться может только реакция окисления метана в метанол, которая является столь же простой на первый взгляд и столь же трудной для реального воплощения, как и окисление бензола. Осуществление этих реакций, несомненно, останется заветной мечтой и для химиков XXI века. Открытие цеолитных катализаторов для окисления бензола закисью азота Закись азота была открыта Пристли в конце 18 века. Вслед за Дэви, который в 1799 г. изучил ее физиологические свойства, закись азота называют «веселящим газом», поскольку вдыхание N2O приводит человека в веселое расположение духа. Благодаря легкому наркотическому действию, ее нередко используют в качестве анестезирующего средства. Термодинамически N2O - неустойчивая эндотермическая молекула, свободная энергия образования которой равна ΔG fo =103,6 кДж/моль. Однако кинетически закись азота весьма стабильна, ее некаталитическое разложение становится заметным лишь при температуре выше 600 оС. В 1983 году Ивамото с сотруд. впервые использовал
закись азота для окисления бензола в фенол [57]: 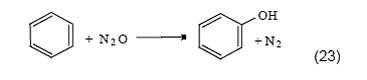
Эта реакция позволила выйти на принципиально новый уровень селективности по фенолу. При температуре 550 оС и добавлении в реакционную смесь 30% H2O селективность по фенолу на нанесенных ванадиевых катализаторах достигала 71% при конверсии бензола 10%. Этот результат вызвал со стороны ученых оживленные отклики, в которых особо подчеркивалась экологическая безопасность нового процесса и давались весьма оптимистические оценки относительно его практической перспективы [58, 59]. Однако пилотные испытания, проведенные в реакторе с кипящим слоем катализатора, не подтвердили эти ожидания. Селективность ванадиевых катализаторов оказалась недостаточно высокой для практического применения процесса. Тем не менее, работа Ивамото и сотруд. [57] стимулировала поиск новых более эффективных катализаторов. Испытания огромного числа каталитических систем выявили чрезвычайно высокую требовательность реакции окисления бензола в фенол закисью азота. Катализаторы оказывались либо неактивными, либо неселективными [60]. В 1988 г. три группы исследователей – Сузуки с соавт. [61] (Токийский технологический институт), Губельманн и Тирель [62] (фирма «Rhone Poulenc») и Харитонов с соавт. [63] (Институт катализа СО РАН) независимо показали, что лучшими катализаторами этой реакции являются цеолиты ZSM-5. На цеолитах реакция протекает при значительно более низкой температуре и, что особенно важно, с селективностью по фенолу, близкой к 100%. Несмотря на сравнительно небольшой выход фенола, полученный в этих работах, было ясно, что найдена перспективная основа для создания новых катализаторов. Дальнейшие исследования [64—74] позволили значительно улучшить каталитические свойства цеолитов и расширить круг катализируемых ими реакций, включая окисление закисью азота различных производных бензола. | 